



链引发: ,
链增长:部分反应进程与势能变化关系如图(所有物质状态为气态)……
链终止: ,
下列说法错误的是


 (g)
(g) (g)为吸热反应
B .
(g)为吸热反应
B .  (g)
(g) (g)
(g) B .
B .  C .
C .  D .
D . 
反应I:ClCH2CH2Cl(g)→HCl(g)+CH2=CHCl(g) ΔH1=+69.7 kJ•mol-1
反应Ⅱ:HC≡CH(g)+HCl(g)→CH2=CHCl(g) ΔH2=-98.8 kJ•mol-1
1.0×105Pa下,分别用如表三种方式进行投料,不同温度下反应达到平衡时相关数据如图所示。|
方式 |
气体投料 |
平衡时相关数据 |
|
甲 |
ClCH2CH2Cl |
ClCH2CH2Cl转化率 |
|
乙 |
n(HC≡CH):n(HCl)=1:1 |
HC≡CH转化率 |
|
丙 |
n(ClCH2CH2Cl):n(HC≡CH)=1:1 |
CH2=CHCl产率 |

下列说法错误的是
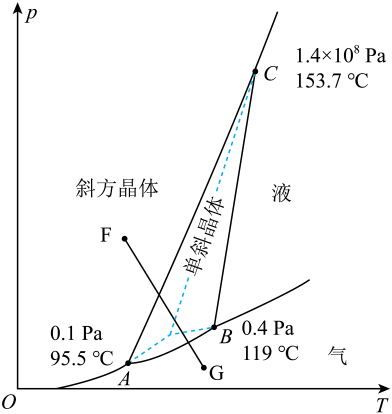
S(斜方,s)
;
S(单斜,s)
。
则下列有关说法中正确的是
(ⅰ)直接脱氢:
(ⅱ)氧化脱氢:
回答下列问题:
②氧化脱氢的反应趋势远大于直接脱氢,其原因是。
③提高氧化脱氢反应平衡转化率的措施有、。

①直接脱氢反应在常温下(选填“能”或“不能”)自发。
②随温度的变化曲线为(选填“a”或“b”),判断的理由是。
③在某温度、下,向密闭容器中通入
气态乙苯发生直接脱氢反应,达到平衡时,混合气体中乙苯和氢气的分压相等,该反应的平衡常数
(保留小数点后一位;分压
总压
物质的量分数)。
反应 | ||
①脱硝反应
的
。
时,为了提高该反应中NO的平衡转化率,理论上可采取的措施是。
A.恒容时增大的压强 B.减小反应容器的容积
C.移去部分 D.选择合适的催化剂
②另一脱硝反应
的
。

当温度低于时,NO的去除率随温度升高而升高,可能原因是;高于
时,NO的去除率随温度升高而降低,结合(1)的信息分析其可能原因是。
I.
Ⅱ.
Ⅲ.
Ⅳ.
V.
上述反应机理中,Ⅱ~V中速率最慢的步骤是。若电路中有电子流过,其中生成
的选择性为95%,电解池阴极生成的
的物质的量为mmol。
①
②
③
计算反应④的
;
⑤
⑥
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S()随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是,理由是;

苯乙烯聚合有多种方法,其中一种方法的关键步骤是某(Ⅰ)的配合物促进
(引发剂,X表示卤素)生成自由基
, 实现苯乙烯可控聚合。
Ⅰ.MgH2热分解放出H2
MgH2(s)Mg(s)+H2(g) ΔH=+75kJ/mol
该反应的能量变化如图。

MgH2与H2O反应制备H2的化学方程式是。

已知:ⅰ.
物质 | Mg(OH)2 | Ni(OH)2 | Cu(OH)2 |
Ksp | 5.6×10-12 | 5.5×10-16 | 2.2×10-20 |
ⅱ.MgH2在MCl2(M代表Mg、Ni、Cu)溶液中水解的示意图如图。

①NiCl2溶液制备H2的性能优于MgCl2溶液,原因是。
②MgH2在MgCl2溶液中制备H2的性能不如在NiCl2溶液中优异,但使用MgCl2溶液利于发展“镁-氢”循环经济,原因是。
③CuCl2溶液制备H2的性能不如NiCl2溶液,可能的原因是。