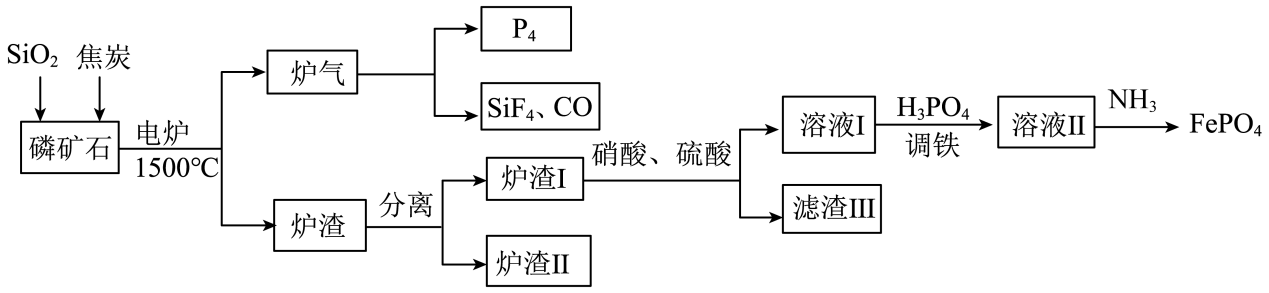
已知:①FePO4可溶于pH<2的酸性溶液。
②Fe3+在pH为2.0时开始沉淀,pH为4.0时沉淀完全。
回答下列问题:
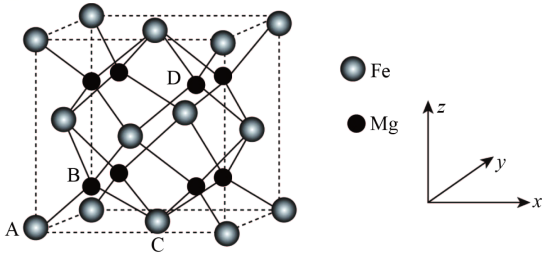
其中A的原子坐标参数为(0,0,0), B为( ,
,
),C为(
,
, 0),则D点的坐标参数为。此晶胞中Fe的配位数是。
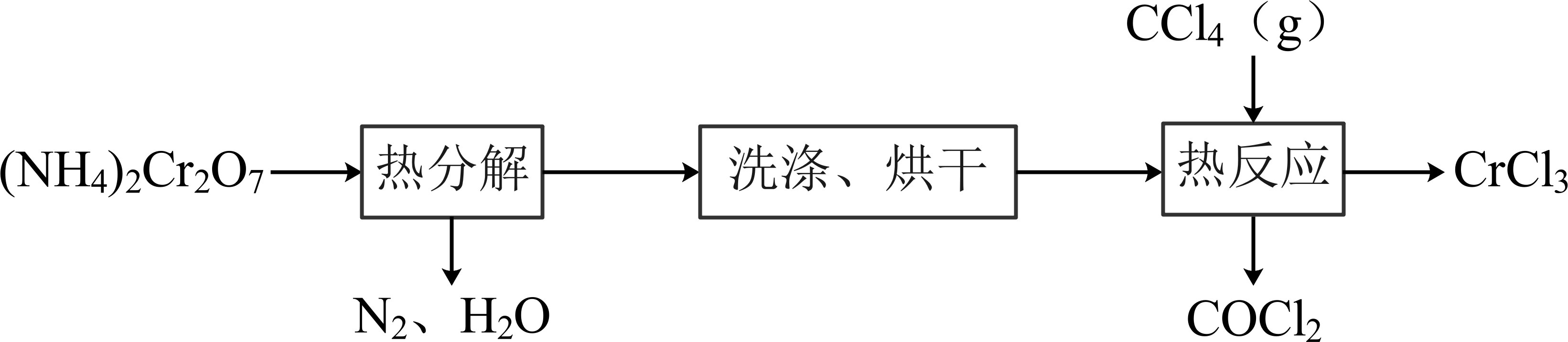
已知:沸点为
, 有毒,易水解。

①加热反应前通的目的是。
②A中仪器X的名称是,其作用是。
③E中收集的物质含有(写化学式)。
④尾气经处理后可循环使用。
①中存在的化学键有(填序号)。
a.配位键 b.氢键 c.离子键 d.金属键
②该暗绿色晶体的化学式为。
已知:①
②
③

①CO的平衡转化率a=;T1℃时,反应平衡常数k=(保留2位有效数字)。
②由T1℃时上述实验数据计算得到v正~x(CO)和v逆~x(H2)的关系如图1所示。若升高温度,反应重新达到平衡,则v正~x(CO)相应的点变为、v逆~x(H2)相应的点变为。

