
①CO2(g)+4H2(g)=CH4(g)+2H2O(l) ΔH1=-252.9 kJ·mol-1
②2H2O(l)=2H2(g)+O2(g) ΔH2=+571.6 kJ·mol-1
下列说法错误的是
化学键 | O-H | H-H | O-O |
键能kJ·mol-1 | 463 | 436 | 498.3 |
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入 | 有黄色沉淀生成 |
③ | 滴入 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
反应I.
反应II.
压强分别为、
时,将
的混合气体置于密闭容器中反应,不同温度下体系中
的平衡转化率和
、CO的选择性如图所示。
(或CO)的选择性

下列说法正确的是
容器编号 | 温度(K) | 起始物质的量(mol) | 平衡时 | 平衡常数 | ||
Ⅰ | 530 | 0.05 | 0.05 | 0 | 0.025 | |
Ⅱ | 530 | 0.03 | 0.03 | 0.01 | ||
Ⅲ | 510 | 0 | 0 | 0.05 | ||

①写出表示甲烷燃烧热的热化学方程式:。
②CO的燃烧热△H=kJ·mol-1。

①第一步反应的热化学方程式为。
②第二步反应的△H0(填“>”、“<”或“=”)。
③从图象分析决定生产尿素的总反应的反应速率的步骤是第步反应。

实验序号 | A溶液 | B溶液 |
① | 20 mL 0.01 mol·L | 30 mL 0.01 mol·L |
② | 20 mL 0.01 mol·L | 30 mL 0.01 mol·L |
完成上述反应的离子方程式为: , 该实验是探究对反应速率的影响。

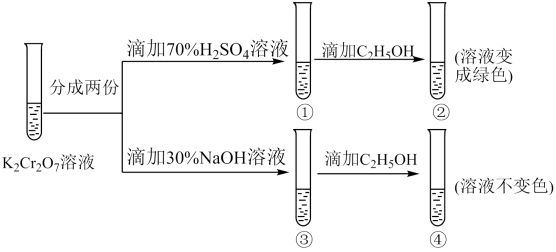
向溶液中加入30%NaOH溶液。溶液呈色:向
溶液中逐滴加入
溶液(已知
为黄色沉淀),则平衡向着方向移动,溶液颜色变化为。
①0.01mol•L﹣1NaOH溶液的pH是多少?
②0.005mol•L﹣1H2SO4溶液中,水电离出的氢氧根浓度是多少?

a.图中A,B,D三点处Kw的大小关系:B>A>D
b.AB线上任意点的溶液均显中性
c.B点溶液的pH=6,显酸性
d.图中温度T1>T2
①盛装0.2000 mol/L盐酸标准液应该用式滴定管。
②终点判断方法:。
③有关数据记录如下:
实验序号待测液体积(mL)所消耗盐酸标准液的体积(mL)
实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.60 | 20.70 |
2 | 20.00 | 6.00 | 25.90 |
3 | 20.00 | 0.40 | 23.20 |
则NaOH溶液的物质的量浓度为mol/L。(保留四位有效数字)
④若滴定时锥形瓶未干燥,则测定结果;(填“无影响”、“偏高”或“偏低”)。


①该离子交换膜为(填“阳”或“阴”)离子交换膜。
②电池负极反应式为。
③当电路中转移0.2 mol电子时,理论上消耗标准状况下O2的体积为L,需补充物质X的化学式为。