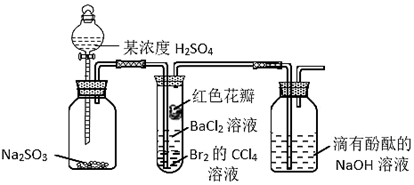

| 实验 | | ||||
| 记录 | A | 蓝色 | 无色 | 白色沉淀 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 红色 | 无色 | 无色溶液 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
①浓硫酸使蔗糖变黑
②碳投入热的浓硫酸中溶解
③浓硫酸与氧化铜反应
④浓硫酸干燥氢气
①浓硝酸需避光保存
②常温下可用铝或者铁遇浓硝酸钝化
A.氧化性B.漂白性C.还原性D.酸性氧化物的性质
①SO2+2OH-= +H2O
②SO2+2H2S=3S↓+2H2O
③SO2+Ca(OH)2=CaSO3↓+H2O
④SO2+Cl2+2H2O=2HCl+H2SO4
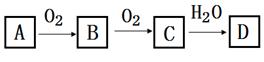
①D的化学式是;
②在工业生产中,B气体的大量排放被雨水吸收后形成了而污染了环境。
①A、C的化学式分别是:A;C 。
②请写出C→D的反应化学方程式 。该反应与中,氧化剂与还原剂的物质的量之比为。

a.Ge与H2化合难于Si
b.GeO2既有氧化性又有还原性
c.酸性H2GeO3>H2SiO3
d.Si和Ge都可做半导体材料
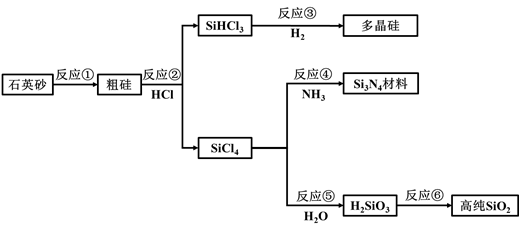
①分别写出生成D和F的化学方程式:、。
②要将NaOH高温熔化,下列坩埚中可选用的是。
a.普通玻璃坩埚
b.石英玻璃坩埚
c.氧化铝坩埚
d.铁坩埚
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
③钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1∶2