
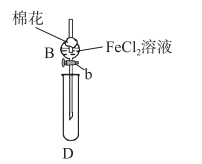
I.往B中的FeCl2溶液(约10mL)中通入一定量的Cl2充分反应。
II.打开活塞b,放出约2mL反应后的溶液到试管D中,关闭活塞b。取出试管D,检验D中的离子。
III.再往B中的溶液中通入一定量的SO2气体。
IV.试管D更换为试管F,打开活塞b,放出约2mL反应后的溶液到试管F中,关闭活塞b。取出试管F,检验F中溶液的离子。
|
步骤II中检出的离子 |
步骤IV中检出的离子 |
|
|
甲 |
有Fe3+无Fe2+ |
有SO |
| 乙 | 既有Fe3+又有Fe2+ | 有SO |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
试回答:
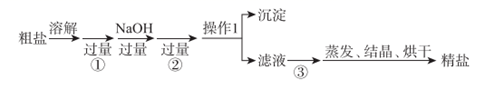
操作1名称为,需要使用的玻璃仪器是;蒸发时时停止加热。

已知:As2S3与过量的S2-可发生反应:As2S3(s)+3S2-(aq) 2AsS
回答下列问题:
As元素在元素周期表中位于N元素的下方,下列说法错误的是(填序号)。
①As元素非金属性比N强
②N的原子半径比As的原子半径小
③HNO3的酸性比H3AsO4强

①该反应是(填“吸热”或“放热”)反应,其原因是反应物化学键断裂吸收的总能量(填“大于”或“小于”)生成物化学键形成放出的总能量。
②关于N2和H2在催化剂表面合成氨气的过程,下列说法正确的是(填序号)。
A.图甲中曲线a表示有催化剂时的能量变化情况
B.催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键
C.在图乙②过程中,N2、H2断键形成氮原子和氢原子
D.使用催化剂可以使生成的氨气的量增多
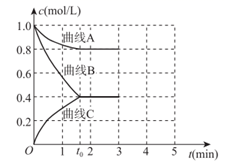
①表示c(N2)变化的曲线是(填“A”“B”或“C”)。
②0~t0时用H2表示的化学反应速率:v(H2)=mol·L-1·min-1。
③下列能说明该反应达到平衡状态的是(填序号,可多选)。
a.容器中的压强不随时间变化
b.2c(H2)=3c(NH3)
c.容器中混合气体的密度不随时间变化
d.断裂3molH—H键的同时断裂6molN—H键