|
催化剂 |
Ru |
Rh |
Ni |
Pt |
Pd |
Fe |
|
初始速率 |
7.9 |
4.0 |
3.0 |
2.2 |
1.8 |
0.5 |
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是(填写催化剂的化学式)。
②温度为T时.在恒容的密闭容器中加入2molNH3此时压强为p0用Ru催化氨气分解,若平衡时氨气的转化率为50%.,则该温度下反应2NH3(g) N2(g)+3H2(g)的化学平衡常数Kp=。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
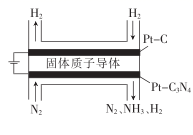
①Pt—C3N4 , 电极上产生NH3的电极反应式为。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:。
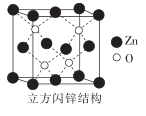
①配合物[Zn(NH3)4]SO4中,[Zn(NH3)4]2+的名称是。
② 中,中心原子的轨道杂化类型为。
③NH3极易溶于水,除了因为它们都是极性分子外还因为。
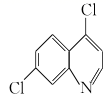 是合成磷酸氯喹的中间体,可由苯在一定条件下合成,具合成路线如下:
是合成磷酸氯喹的中间体,可由苯在一定条件下合成,具合成路线如下: 
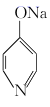
已知: ![]() +NaOH
+NaOH
 +H2O
+H2O
回答下列问题
①分子中含有甲基
②1molM能与足量的碳酸氢钠溶液反应生成标准状况下的气体44.8L
③核磁共振氢谱显示只有3组峰,且峰面积之比为9:2:l
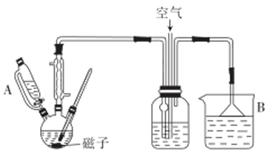
实验步骤:在装有回流冷凝管、温度计的50mL三颈烧瓶中,加入50%HNO3溶液(含0.12molHNO3)及少量钒酸铵(0.01g),缓慢滴加5~6滴环己醇.有红棕色气体二氧化氮产生,将剩余的环己醇滴加完毕,总量为2mL(约0.02mol)。在温度为80~90℃时,反应至无红棕色气体逸出。将反应液倒入50mL的烧杯中,冷却后。析出已二酸。减压过滤,用15mL冷水洗涤,干燥后得到粗产品mg。
回答以下问题.