|
温度/℃ |
400 |
500 |
|
平衡常数K |
9 |
5.3 |
①该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的△S(填“>”或“<”")0。
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为。
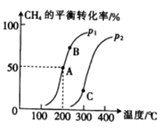
①200 ℃时,该反应的平衡常数K=。
②A、B、C三点的平衡常数KA、KB、KC的大小关系是。
③压强:p1 (填“>”“<”或“=”)p2。
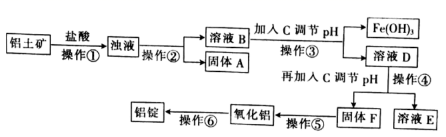
已知部分氢氧化物沉淀的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀时的pH(离子初始浓度为0.01 mol/L) | 3.7 | 2.2 | 9.6 |
| 完全沉淀时的pH(离子浓度<10-5 mol/L) | 4.7 | 3.2 | 11.1 |
请回答下列问题:
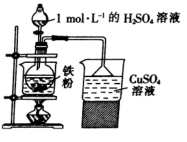
实验步骤如下:
①称取0.7g铁粉,用10mL10%Na2CO3溶液煮沸洗净,加入烧瓶中,再加入10 mL1 mol/LH2SO4溶液反应。
②保持温度在70~80℃之间,至反应无明显气泡产生,停止加热,过滤,称量残余固体质量。
③向FeSO,溶液中加入一定质量的(NH4)2SO4固体,在70~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。用95%的酸性乙醇溶液洗涤晶体两次,用滤纸吸干,即可得到硫酸亚铁铵晶体。
回答下列问题:
①滴定终点时的现象是。
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为(保留4位有效数字)。
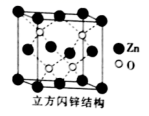
①配合物[Zn(NH3)4]SO4中,[Zn(NH3)4]2+ 的名称是,中心原子的配位数为;NH3为该配合物的。
② 中,中心原子的轨道杂化类型为。
③NH3极易溶于水,除了因为它们都是极性分子外,还因为。

已知: 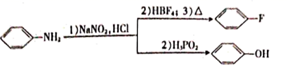
回答下列问题:
