
| 序号 | 时间/min | 0 | 10 | 20 | 30 | 40 | 60 |
| ① | 温度T1 / 1号Cu2O | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 温度T1 / 2号Cu2O | 0.0500 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 温度T2 / 2号Cu2O | 0.0500 | 0.0480 | 0.0470 | 0.0470 | 0.0470 | 0.0470 |
下列说法不正确的是( )
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸
④加 CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴CuSO4溶液
⑦升高温度(不考虑盐酸挥发) ⑧改用10mL 1mol·L-1盐酸
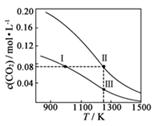



Ⅰ.CO(g)+2H2(g) CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g)△H3
回答下列问题

①反应(Ⅱ)的△H(填“>”或“<”)0。
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=。
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=(KP为以分压表示的平衡常数,分压=总压×物质的量分数)。
(A.变快 B.不变 C.变慢,填字母代号)。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式:。
方法一:在恒容密闭容器中将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
①下列条件可以判定该反应到达平衡状态的是(填字母)。
A.2v正(H2)=v逆(CH3OH) B.容器内气体的密度不变
C.容器内压强不变 D.反应不再释放热量
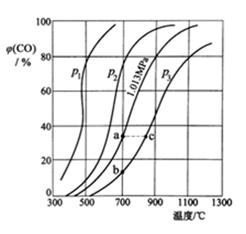
方法二:让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g) 2CO(g) ∆H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
② 图中p1、p2、p3的大小关系是,图中a、b、c三点对应的平衡常数Ka、Kb、Kc大小关系是。
③ 900 ℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V L,CO2的转化率为(保留一位小数),该反应的平衡常数K=。
方法三:用NaOH溶液吸收CO2。
④在NaOH溶液中通入一定量的CO2气体,所得溶液中c(HCO32-):c(CO32-)=4:1,此时溶液的pH=。(已知:室温下,H2CO3的K1=4×10-7 , K2=5×10-11。lg2=0.3)
| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1 173 K | 2.15 | 1.67 |
请填空:

①图甲中t2时刻发生改变的条件是。
②图乙中t2时刻发生改变的条件是。