
常温条件下的有关数据如表所示:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/g•cm﹣3 | 颜色 | 水溶性 | |
对氯甲苯 | 126.5 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
对氯苯甲酸 | 156.5 | 243 | 275 | 1.54 | 白色 | 微溶 |
对氯苯甲酸钾 | 194.5 | 具有盐的通性,属于可溶性盐 | ||||
实验步骤:在规格为250mL的装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g.
请回答下列问题:

回答下列问题:
①活性炭粉末作为黄磷的分散剂,目的是
②a中反应的化学方程式为
|
s(25℃ ) |
s(100℃ ) |
|
|
NaCl |
37 |
39 |
|
NaH2PO2 |
100 |
667 |
充分反应后,将a、c中溶液混合,将混合液(含极少量NaOH)蒸发浓缩,有大量晶体析出,该晶体主要成分的化学式为,然后,再冷却结晶、过滤、洗涤、干燥,得到含NaH2PO2的粗产品。
取产品1.50克配成250mL溶液,取25mL于锥形瓶中,酸化后加入25mL,0.10mol/L碘水,于暗处充分反应后,以淀粉溶液做指示剂,用0.10
mol/L Na2S2O3溶液滴定至终点,平均消耗18.00mL,相关反应方程式为:H2PO +H2O+I2=H2PO
+2H++2I- , 2S2O
+I2=S4O
+2I-。产品纯度为
已知:PCl3、POCl3的部分性质如下:
熔点/℃ | 沸点/℃ | 其它 | |
PCl3 |
| 75.5 | 遇水生成H3PO3和HCl |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl |
某兴趣小组模拟该工艺设计实验装置如图(某些加持装置、加热装置已略去):


其中表示的是曲线 (填“I”或“II”),Na2HPO3溶液中,各离子浓度由大到小的顺序为。
①取a g产品置于盛60.00 mL蒸馏水的水解瓶中,摇动至完全水解,将水解液配成100.00 mL溶液并预处理排除含磷粒子的影响。
②取10.00 mL溶液于锥形瓶中,向其中加入c1 mol/L的AgNO3溶液V1 mL,使Cl-完全沉淀,再加入20 mL硝基苯,振荡,使沉淀表面被有机物覆盖;然后加入几滴Fe(NO3)3溶液作指示剂,用c2 mol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积为V2 mL。[已知: ,
]则产品中POCl3的百分含量为(填表达式)。实验过程中加入硝基苯的目的是;若无此操作,则所测POCl3的含量将 (填“偏高”、“偏低”或“不变”)。
I.制备流程图
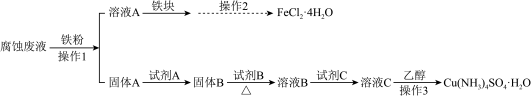
已知1.所加试剂均足量,且部分步骤有省略。
II.Cu(NH4)2SO4•H2O晶体纯度测定
①取a g Cu(NH4)2SO4•H2O晶体,加入适量1 mol·L-1稀硫酸,加热,待溶液冷却后配制成250 mL溶液。
②取25.00 mL溶液,加水50 mL,调节溶液至弱酸性(pH=3~4),加入过量20%KI溶液,避光静置几分钟。
③用c mol·L-1Na2S2O3标准溶液滴定至溶液呈淡黄色,再加入淀粉溶液,继续滴定至溶液变浅蓝色,再加入一定量10%KSCN溶液,蓝色变深,继续滴定至蓝色刚好消失,记录消耗Na2S2O3标准溶液的体积。
④平行滴定三次,消耗Na2S2O3标准溶液的平均体积为V mL。
已知2:①2Cu2++4I-=2CuI↓+I2;I2+2=
+2I-。
②CuI和CuSCN均为白色固体;Ksp(CuI)=1.1×10-12 , Ksp(CuSCN)=4.8×10-15。
请回答: