| 相关实验 | 预期目的 | |
| A | 不同温度下,取0.1 mol·L-1KI溶液,向其中先加入0.1 mol·L-1的硫酸,再加入淀粉溶液,发生反应4H++O2+4I- =2I2+2H2O | 探究溶液出现蓝色的时间与温度的关系 |
| B | 相同温度下,测定等浓度的Na2CO3和CH3COONa的pH | 比较H2CO3和CH3COOH酸性强弱 |
| C | 在加热搅拌的条件下向溶液中加入足量的MgCO3 , 过滤后,再向滤液中加入适量盐酸 | 除去MgCl2酸性溶液中的Fe3+ |
| D | 向5mL0.1 mol·L-1AgNO3溶液中滴几滴0.1mol·L-1NaCl溶液,生成白色沉淀,再滴加几滴0.1 mol·L-1KI溶液,观察沉淀颜色变化 | 探究AgCl沉淀能否转化为 AgI沉淀 |

已知:除铁时若pH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀,回答下列问题:


回答下列问题:
①活性炭粉末作为黄磷的分散剂,目的是
②a中反应的化学方程式为
|
s(25℃ ) |
s(100℃ ) |
|
|
NaCl |
37 |
39 |
|
NaH2PO2 |
100 |
667 |
充分反应后,将a、c中溶液混合,将混合液(含极少量NaOH)蒸发浓缩,有大量晶体析出,该晶体主要成分的化学式为,然后,再冷却结晶、过滤、洗涤、干燥,得到含NaH2PO2的粗产品。
取产品1.50克配成250mL溶液,取25mL于锥形瓶中,酸化后加入25mL,0.10mol/L碘水,于暗处充分反应后,以淀粉溶液做指示剂,用0.10
mol/L Na2S2O3溶液滴定至终点,平均消耗18.00mL,相关反应方程式为:H2PO +H2O+I2=H2PO
+2H++2I- , 2S2O
+I2=S4O
+2I-。产品纯度为
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-49.2kJ/mol
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2kJ/mol
则反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) △H3=kJ/mol
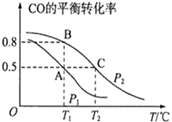
①A、B、C三点的平衡常数KA , KB , KC的大小关系是。
②下列叙述能说明上述反应能达到化学平衡状态的是(填代号)。
a.2v正(H2)=v逆(CH3OH)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不变
d.H2(g)与CH3OH(g) 的物质的量之比保持不变
③在容积为2L的密闭容器内充入0.3molCO与0.6molH2在催化剂作用下发生反应生成甲醇。A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tAtC(填“大于”“小于”或“等于");若P2压强恒定为p,则T2℃平衡常数Kp=(Kp用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
 该锰元素的氧化物化学式为,该晶体的密度为
该锰元素的氧化物化学式为,该晶体的密度为 (用含a、b和NA的代数式表示,NA为阿伏加德罗常数的值)。