
①取100 mL上述溶液,加入过量溶液,反应后将沉淀过滤、洗涤、干燥,得白色沉淀;
②向沉淀中加入过量的盐酸,白色沉淀部分溶解,并有气体生成。
下列说法正确的是( )


主要成分 | 杂质 | 除杂试剂 | 分离方法 | |
A | 乙醇 | 水 | CaO | 蒸馏 |
B | 乙烷 | 乙烯 | 酸性高锰酸钾溶液 | 洗气 |
C | 苯 | 苯酚 | NaOH溶液 | 分液 |
D | 蛋白质溶液 | 葡萄糖 | 浓 | 盐析、过滤、洗涤、溶解 |
①加水搅拌溶解,有白色沉淀B生成,过滤得无色溶液C;
②取白色沉淀B于试管中,加入足量的稀盐酸,沉淀全部溶解且有无色气体放出;
③另取无色溶液C,通入定量的 , 有白色沉淀D生成,过滤得无色滤液E。
下列说法错误的是( )

流程中几种物质的沸点如表
物质 | ||||
沸点 | 136 | 127 | 57 | 180 |
离子 | Ca2+ | Mg2+ | HCO | 其他 |
含量(mol/L) | 1.2×10-3 | 6.0×10-4 | 8.0×10-4 | / |
现要用化学方法软化10m3这种天然水,则需要先加入Ca(OH)2g以除去Mg2+和HCO , 后加入Na2CO3g以除去Ca2+(要求写出计算过程)。
实验要求 | 化学试剂 |
检验酒精中是否有水 | |
区别CH4和C2H4两种无色气体 | |
验证味精是否有食盐 | |
除去Fe2O3中的Al2O3 |
供选择的化学试剂:
A.酸性高锰酸钾B.硝酸银溶液和硝酸C.氢氧化钠溶液D.无水硫酸铜粉末.
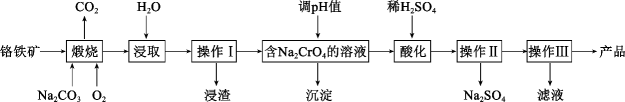
 )是一种非常高效的强氧化性消毒剂。常温下是白色固体,难溶于冷水;合成二氯异氰尿酸钠的反应为
)是一种非常高效的强氧化性消毒剂。常温下是白色固体,难溶于冷水;合成二氯异氰尿酸钠的反应为
请回答下列问题:
准确称取mg样品,配成100mL溶液,取20.00mL所配溶液于碘量瓶中,加入稀H2SO4和过量KI溶液,充分反应后,加入淀粉溶液,用标准溶液滴定,滴到终点时,消耗Na2S2O3标准溶液的体积为VmL,则样品有效氯含量为%(有效氯含量
)。

实验步骤:
I.按图示连接装置,先将C与D连接处断开,再对装置A中粗砂加热,待温度升到150℃左右时,连接C与D,并迅速将A内反应温度升温至160~180℃,从滴液漏斗中慢慢滴加乙醇和浓硫酸混合液,装置D试管中装有6.0mL10mol/LBr2的CCl4溶液,待Br2的CCl4溶液褪色后,进行1,2-二溴乙烷的纯化。
完成下列填空:
a.冰水混合物 b.5℃的水 c.10℃的水
步骤①:冷却后,把装置D试管中的产物转移至分液漏斗中,用1%的氢氧化钠水溶液洗涤。
步骤②:用水洗至中性。
步骤③:“向所得的有机层中加入适量无水氯化钙,过滤,转移至蒸馏烧瓶中蒸馏,收集130~132℃的馏分,得到产品7.896g。
步骤①中加入1%的氢氧化钠水溶液时,发生反应的离子方程式为。

[已知:+
→CO2↑+Mn2+(未配平)]


已知: (
(、
、
表示烃基)
①只有Fe ②只有 ③Fe,