
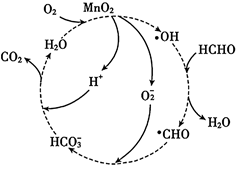
 B .
B .  C .
C .  D .
D . 
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液。
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是( )
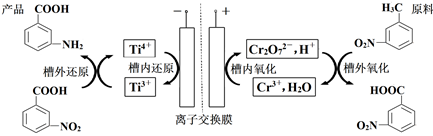
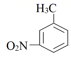 +Cr2O
+Cr2O 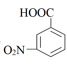 +2Cr3++5H2O
C . 通电时阳极区pH增大
D . 当电路中转移1mole-时,理论上可得到1mol间氨基苯甲酸
+2Cr3++5H2O
C . 通电时阳极区pH增大
D . 当电路中转移1mole-时,理论上可得到1mol间氨基苯甲酸
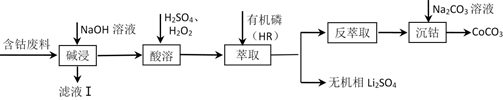
已知:萃取Co2+的反应原理:Co2++2HR(有机磷) CoR2+2H+。下列说法错误的是( )

a.Na2CO3
b.Fe
c.NaOH
d.KMnO4
从物质类别上看,HCl 属于酸,可能与 HCl 反应的有(填字母);

部分阳离子以氢氧化物形式沉淀时溶液
|
沉淀物 |
|
|
|
|
|
完全沉淀的 |
3.7 |
9.6 |
9.2 |
5.2 |
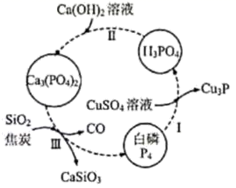
回答下列问题:

已知:①与
同主族,其化学性质相似。
②随着温度升高,在水溶液中的溶解度减小:
温度/ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/ | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
③本工艺流程中,不同金属离子形成氢氧化物沉淀的范围如表格所示:
金属离子 | 形成氢氧化物沉淀的 |
3.3~10.6 | |
2.9~9.4 |
回答下列问题:
|
滴定次数 |
待测溶液体积/mL |
标准溶液体积/mL |
|
|
滴定前刻度 |
滴定后刻度 |
||
|
1 |
20.00 |
1.50 |
23.70 |
|
2 |
20.00 |
1.02 |
21.03 |
|
3 |
20.00 |
2.00 |
21.99 |
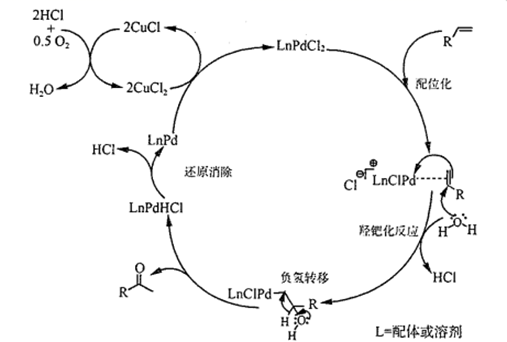
回答下列问题:
①制取NO的离子方程式为
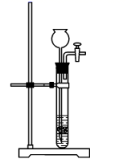
②选用下列部分装置预制备一瓶干燥纯净的氯气,各玻璃导管接口连接顺序为(气流方向从左至右)。
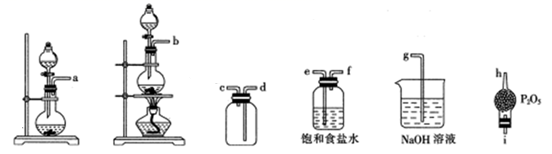
反应原理:NaNO2+2HCl=NOCl↑+NaCl+H2O。制取装置图:

①仪器X的名称为,用它代替分液漏斗的优点是
②装置C的U形管中观察到的现象是,装置D的作用是
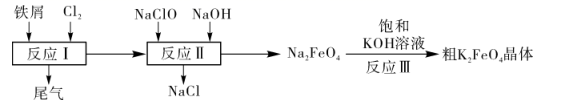
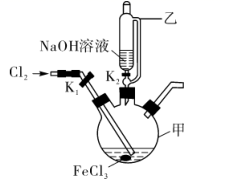
某化学兴趣小组模拟上述流程,在实验室中探究制备K2FeO4的方法,回答下列问题:
查阅资料:K2FeO4具有强氧化性,在酸性或中性溶液中易快速产生O2 , 在碱性溶液中较稳定。
a.  b.
b. 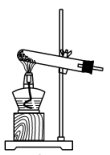
c. 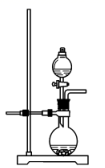 d.
d.