①冰水混合物属于纯净物,高分子化合物属于混合物
②CaCl2、NaOH、HCl、HT四种物质都是化合物
③0℃,101kPa,含有1mol硫原子的SO2与SO3的混合物,其体积小于22.4L
④既能与酸反应又能与碱反应的氧化物属于两性氧化物
⑤AlCl3属于共价化合物,故AlCl3是非电解质;胆矾、苛性钠、冰醋酸、氧化钾均是电解质
⑥向新制氯水中加入碳酸钙粉末,能提高溶液中HClO的浓度
⑦1molBrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子的物质的量为1mol
⑧碘的升华、NaOH潮解、胶体渗析、氯化钠溶液导电、煤的干馏均属于物理变化


在通常状况下,(填“金刚石”或“石墨”)更稳定;石墨的燃烧热ΔH为
用液氯消毒自来水会产生微量有机氯代物,危害人体健康,可使用二氧化氯(ClO2)代替液氯工业上以黄铁矿(FeS2)、氯酸钠(NaClO3)和硫酸溶液混合制备二氧化氯。已知黄铁矿中的硫元素( 价)被氧化成SO42- , 制备二氧化氯的离子方程式为。

①硒化锆的沸点远低于氧化锆,原因为,硒化锆和氧化锆的配位数分别为、。
②已知阿伏加德罗常数的值为NA , 据图乙中数据计算氧化锆的密度为g‧cm-3(用含NA和a的代数式表示,列式即可)
次氯酸钠的制备。装备如图所示(夹持装置略去)。

已知:用30%~35%的NaOH水溶液在低于10℃时吸收Cl2可制得NaClO。
a.按要求连接装置,检查装置气密性,盛装相应试剂
b.拆卸装置
c.打开K,鼓入一段时间空气
d.确保K关闭后,打开分液漏斗旋塞,滴加浓盐酸
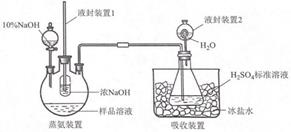
①蒸氨:取 m g 样品进行测定。添加药品后,加热三颈烧瓶,蒸出的 NH3 通入含有V1mLc1 mol•L﹣1H2SO4 标准溶液的锥形瓶中。
液封装置1的作用是
②滴定:将液封装置2中的水倒入锥形瓶后,滴定过剩的H2SO4 , 消耗V2mLC2mol•L﹣1的 NaOH 的标准液产品中 NH3 的质量分数为若未将液封装置 2 中的水倒入锥形瓶,测得 NH3 的质量分数可能(填“偏高”或“偏低”)。