选择题
试题详情
草酸钙是常见的难溶物.将过量草酸钙粉末置于水中达到溶解平衡:CaC2O4(s) Ca2+(ag)+
Ca2+(ag)+ (a)[已知Ksp(CaC2O4)=2.3×10-9 , Ka(H3COOH)=1.75×10-5 , H2C2O4的电离常数Ka1=5.6×10-2 , Ka2=1.5×10-4 , 下列有关说法不正确的是( )
(a)[已知Ksp(CaC2O4)=2.3×10-9 , Ka(H3COOH)=1.75×10-5 , H2C2O4的电离常数Ka1=5.6×10-2 , Ka2=1.5×10-4 , 下列有关说法不正确的是( )
- A、 上层清液中含碳微粒最主要以
形式存在
- B、 上层清液中存在:c(Ca2+)=c(
)+c(
)+c(H2C2O4)
- C、 H2C2O4加入CaCl2溶液时, 加入适量醋酸钠粉末,有利于生成CaC2O4沉淀
- D、 向上层清液中通入HCl至pH=1,则 2c(Ca2+)-2c(
)-c(
)-c(OH-)=0.1 mol/L
试题详情
某温度下, ,
, 。现有体积均为 V0的 pH=a 的两种酸溶液,加水稀释至体积为 V,两种溶液的 pH 随 lg
。现有体积均为 V0的 pH=a 的两种酸溶液,加水稀释至体积为 V,两种溶液的 pH 随 lg  的变化如图所示。下列叙述正确的是( )
的变化如图所示。下列叙述正确的是( )
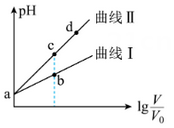
- A、 曲线Ⅱ代表HB
- B、 水的电离程度:b>c
- C、 由c点到d点,溶液中
增大(X 代表A或B)
- D、 分别取b点、c点溶液与等浓度的NaOH溶液中和,恰好中和时消耗NaOH溶液的体积:b>c
试题详情
常温下,向20 mL 0.1mol·L-1的盐酸中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述错误的是( )
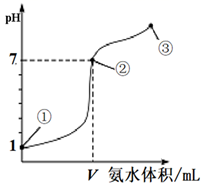
- A、 V>20 mL
- B、 ①、②、③点水的电离程度大小为:②>③>①
- C、 在点②所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH
)
- D、 在点②、③之间可能存在:c(NH
)>c(Cl-)=c(OH-)>c(H+)
试题详情
常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1 HA溶液和HB溶液,所得滴定曲线如图所示(其中HA的滴定曲线部分未画出)。下列说法错误的是( )
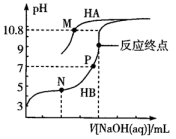
已知:M点溶液中c(A-)=c(HA)
- A、
=105.8
- B、 P点溶液中溶质为NaB和HB,由水电离出的c(H+)=1.0×10-7 mol·L-1
- C、 M点溶液中,2c(Na+)>c(HA)+c(A-)
- D、 等体积等浓度的HB溶液和NaA溶液混合后的溶液中:c(OH-)<c(H+)
试题详情
用0.1mol/L的NaOH溶液滴定20mL0.1mol/L的CH3COOH溶液时,溶液的温度(I)、pH(II)随NaOH体积的变化如下图(图中虚线为校正至25℃时的pH曲线),V1时溶液中  =1。
=1。

下列说法正确的是
- A、 x点溶液中,CH3COOH电离程度小于CH3COONa的水解程度
- B、 y点溶液中,c(CH3COO-)=c(Na+)>c(H+)= c(OH-)
- C、 w点溶液的碱性强于z点溶液的碱性
- D、 25℃时,CH3COOH的电离常数Ka=1×10-a
试题详情
难溶盐 可溶于盐酸,常温下,用
可溶于盐酸,常温下,用 气体调节
气体调节 浊液的
浊液的 , 测得体系中
, 测得体系中 或
或 与
与 的关系如图所示.下列说法不正确的是( )
的关系如图所示.下列说法不正确的是( )
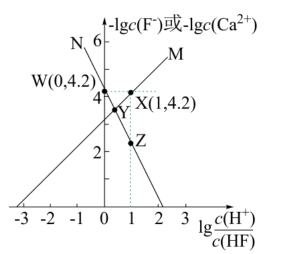
- A、 曲线
代表
随
的变化趋势
- B、
点溶液中存在
- C、 难溶盐
的溶度积常数
- D、 其他条件不变的情况下,无论增大
浓度或减小
浓度,
的
均不变
试题详情
常温下,向10mL0.10mol/LCuCl2溶液中滴加0.10mol/LNa2S溶液,滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法不正确的是
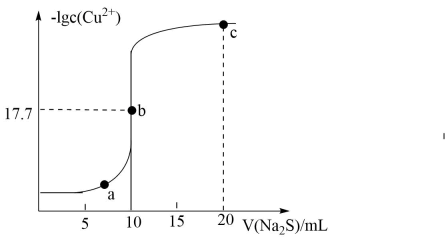
- A、 Ksp(CuS)=10-35.4
- B、 a点溶液中:c(S2-)•c(Cu2+)=Ksp(CuS)
- C、 c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+)
- D、 a、b、c三点溶液中,水的电离程度最大的是b点
多选题
试题详情
部分弱酸的电离平衡常数如表所示:
| 弱酸 | | | |
| 电离常数/( | | | |
下列说法错误的是( )
试题详情
25℃时,向1L某缓冲溶液(含0.1mol·L-1CH3COOH、0.08mol·L-1CH3COONa)和1L0.1mol·L-1CH3COOH溶液中加入NaOH(s)或通入HCl(g),两种溶液的pH变化如图所示(不考虑溶液体积变化)。已知缓冲溶液pH=pKa-lg , 下列说法正确的是( )
, 下列说法正确的是( )

试题详情
已知:常温下,  。某温度下,饱和溶液中
。某温度下,饱和溶液中  与
与  、
、  的关系如图所示。
的关系如图所示。
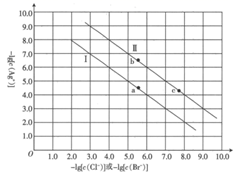
下列说法正确的是( )
试题详情
常温下,用  盐酸滴定
盐酸滴定  某弱碱
某弱碱  溶液,所得溶液
溶液,所得溶液  、
、  和
和  的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述错误的是( )
的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述错误的是( )

试题详情
向一定体积的 的草酸溶液中滴加
的草酸溶液中滴加 的NaOH溶液,溶液中
的NaOH溶液,溶液中 、
、 、
、 的物质的量分数(δ)随pH变化的关系如图所示。下列说法错误的是( )
的物质的量分数(δ)随pH变化的关系如图所示。下列说法错误的是( )
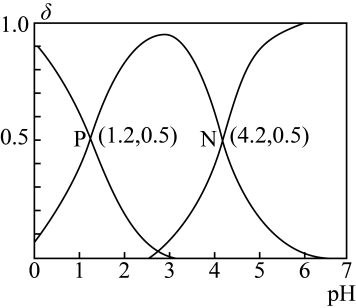
非选择题
试题详情
硫酸的消耗量是衡量一个国家化学工业发展水平的标志。以黄铁矿(主要成分为 )为原料生产
)为原料生产 和
和 。
。
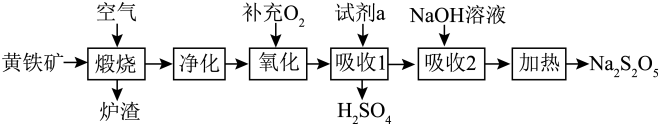
请回答下列问题:
试题详情
下列物质中:① ②
② ③
③ ④盐酸 ⑤
④盐酸 ⑤ ⑥
⑥
试题详情
草酸(H2C2O4)是一种二元有机酸,广泛分布于植物、动物和真菌体中,并在生命体内发挥重要的功能。已知:常温下,部分酸的电离平衡常数如表所示。
H2C2O4 | H2CO3 | HNO2 |
Ka1=5.6×10-2 Ka2=1.5×10-4 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka=5.6×10-4 |
回答下列问题:
试题详情
元素铬 在溶液中主要以
在溶液中主要以 (蓝紫色)、
(蓝紫色)、 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,
(黄色)等形式存在, 为难溶于水的灰蓝色固体,回答下列问题:
为难溶于水的灰蓝色固体,回答下列问题:
试题详情
从废钼催化剂(主要成分为MoS2 , 含少量SiO2、CuFeS2、As2O3)中回收钼酸铵晶体的工艺流程如图所示:
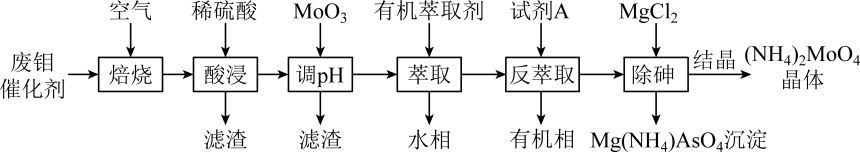
注:酸浸后钼元素以MoO形式存在。
回答下列问题:
试题详情
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O+6H2O
ZnFe2(C2O4)3·6H2O↓
ZnFe2(C2O4)3·6H2O……
某兴趣小组按下列流程制备ZnFe2O4。
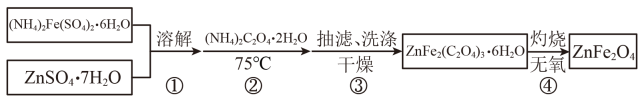
请回答: