选择题
试题详情
下列叙述中正确的是( )
- A、 100 ℃时纯水的pH约为6,所以纯水在100 ℃时显酸性
- B、 常温下,pH=3的盐酸稀释10倍后pH>4
- C、 0.2 mol·L-1醋酸溶液与等体积水混合后pH=1
- D、 常温下,pH=3的盐酸与pH=11的氢氧化钠溶液等体积混合后pH=7
试题详情
无论以何种比例混合,将甲和乙的混合气体通入过量的丙溶液中,一定能产生沉淀的组合是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | NO2 | 石灰水 |
| ② | HCl | CO2 | 石灰水 |
| ③ | CO2 | SO2 | BaCl2 |
| ④ | Cl2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
- A、 ①②④
- B、 ①②⑤
- C、 ①③④
- D、 ③④⑤
试题详情
测定0.1
 溶液升温过程中的pH(不考虑水的蒸发),数据如下。
溶液升温过程中的pH(不考虑水的蒸发),数据如下。
| 温度/℃ | 20 | 40 | 60 | 80 |
| pH | 11.80 | 11.68 | 11.54 | 11.42 |
下列说法正确的是( )
- A、 温度升高,
溶液中
降低
- B、 温度升高时溶液pH降低,原因是
水解生成少量
- C、
溶液pH的变化是
改变与水解平衡移动共同作用的结果
- D、 溶液中
始终等于0.1
试题详情
食品添加剂柠檬酸三钠,使用时必须符合国家标准。用标准的盐酸和电导率仪测得滴加盐酸体积与待测溶液(10mL)电导率的关系如图所示,溶液的浓度均为0.01mol/L。已知:柠檬酸(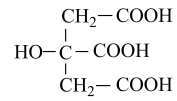 分子式为C6H8O7)属于三元弱酸,25℃其电离平衡常数的pKa=-1gKa , pKa1=3.14,pKa2=4.77,pKa3=6.39。下列说法错误的是( )
分子式为C6H8O7)属于三元弱酸,25℃其电离平衡常数的pKa=-1gKa , pKa1=3.14,pKa2=4.77,pKa3=6.39。下列说法错误的是( )
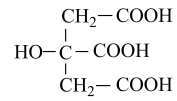 分子式为C6H8O7)属于三元弱酸,25℃其电离平衡常数的pKa=-1gKa , pKa1=3.14,pKa2=4.77,pKa3=6.39。下列说法错误的是( )
分子式为C6H8O7)属于三元弱酸,25℃其电离平衡常数的pKa=-1gKa , pKa1=3.14,pKa2=4.77,pKa3=6.39。下列说法错误的是( )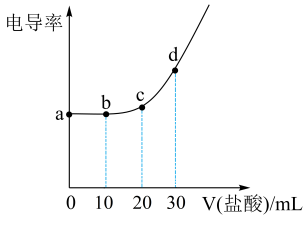
- A、 a点代表正盐溶液,c(H+)的数量级为10-10
- B、 b点溶液显酸性
- C、 c点溶液满足:c(Cl-)>2[c(
)+c(
)+c(
)]
- D、 电导率与离子浓度有关,与离子所带电荷无关
试题详情
用废铜屑(含Cu、CuO、Fe2O3等)制备胆矾的流程如下:
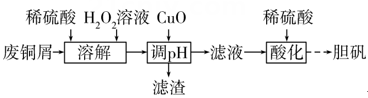

下列说法不正确的是( )
- A、 “溶解”时,铜发生反应的离子方程式为Cu+4H++
= Cu2++2H2O
- B、 “调pH”时,可用Cu2(OH)2CO3代替CuO
- C、 “滤液”中c(Cu2+)·c2(OH-)≤Ksp[Cu(OH)2]
- D、 “酸化”时,加入稀硫酸的目的是抑制Cu2+的水解
试题详情
常温下,用0.1mol·L-1HCl溶液滴定0.1mol·L-1 NH3·H2O溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列说法不正确的是( )
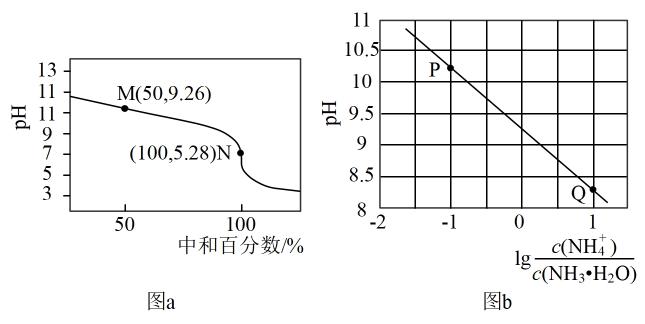
- A、 Kb(NH3·H2O)的数量级为10-5
- B、 P到Q过程中,水的电离程度逐渐增大
- C、 当滴定至溶液呈中性时,c(NH4+)>c(NH3·H2O)
- D、 N点,c(Cl- ) - c(NH4+)=
试题详情
已知: 常温下,(1) Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )
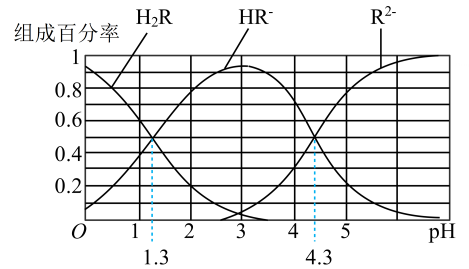
- A、 在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-)
- B、 等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水大
- C、 在pH=3的溶液中存在c(R2−)×c(H2R)/c2(HR−)=10-3
- D、 向Na2CO3溶液中加入少量H2R溶液,发生反应:2
+H2R=2HCO3-+R2-
多选题
试题详情
已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
试题详情
科研小组用氧化—沉淀法从废电池浸出液中去除铁:用MnO2氧化废电池浸出液中的Fe2+ , 再加适量Na2CO3调pH使Fe3+转化为Fe(OH)3沉淀的同时并产生气体。研究发现pH对Fe2+的氧化率和铁去除率的影响如图1和图2所示。
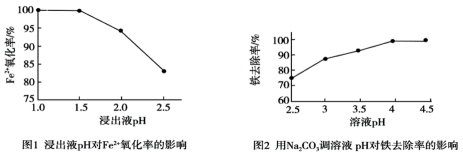
已知:i.pH越大,c(H+)越小;ii.酸性条件下MnO2被还原为Mn2+
下列说法不合理的是( )
试题详情
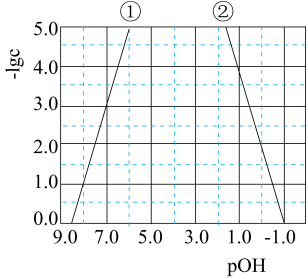
氢氧化锌在水中的溶解反应为:Zn(OH)2(s) Zn2+(aq)+2OH-(aq)、Zn(OH)2(s)+2OH-(aq)
Zn2+(aq)+2OH-(aq)、Zn(OH)2(s)+2OH-(aq) Zn(OH)
Zn(OH) (aq),25℃时,-lgc与pOH的关系如图所示,c为Zn2+或Zn(OH)
(aq),25℃时,-lgc与pOH的关系如图所示,c为Zn2+或Zn(OH) 浓度的值。下列说法正确的是( )
浓度的值。下列说法正确的是( )
非选择题
试题详情
常温下,向100mL0.1molL-1H2S溶液中滴加0.1mol·L-1NaOH溶液。实验过程中,H2S溶液的pH与所滴加的NaOH溶液体积的关系如下图。

已知NaHS溶液显碱性,则:
试题详情
水是生命之源,水在工业、农业和日常生活中均发挥着重要作用。
试题详情
按图连接好装置,如下表清单分别放入不同药品,做多次实验,回答下列问题。
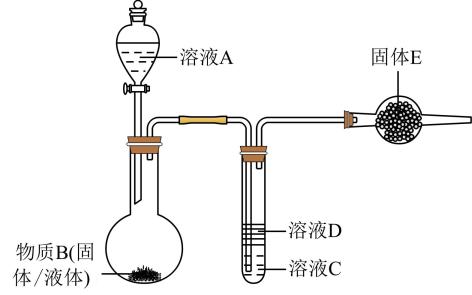
A | B | C | D | E | |
实验1 | 70%的 | | | | 碱石灰 |
实验2 | 浓盐酸 | 浓 | | 淀粉—KI溶液 | 碱石灰 |
实验3 | ? | ? | | | 碱石灰 |
实验4 | 浓氨水 | | | 水 | —— |
试题详情
酸碱中和反应是一类重要的化学反应。
试题详情
回收利用含硫化合物有利于节约资源、保护环境。
试题详情
实验室模拟“镁法工业烟气脱硫”并制备 , 其实验过程可表示为
, 其实验过程可表示为
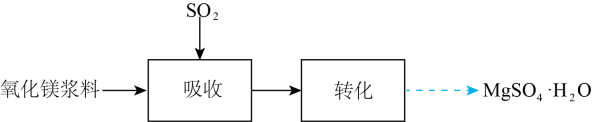

 )、Ⅱ(
)、Ⅱ(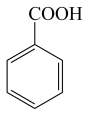 )、Ⅲ(
)、Ⅲ(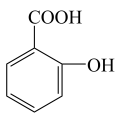 )、Ⅳ(
)、Ⅳ( ),四种物质的酸性由强到弱的顺序为( )
),四种物质的酸性由强到弱的顺序为( )
