选择题
试题详情
反应A(s)+B(g)  2C(g)+3D(g)在0.5 L密闭容器中进行,0.5 min后,A减少了0.6 mol,则反应的速率可表示为( )。
2C(g)+3D(g)在0.5 L密闭容器中进行,0.5 min后,A减少了0.6 mol,则反应的速率可表示为( )。
- A、 v(A)=0.04 mol·L-1·s-1
- B、 v(B)=2.4 mol·L-1·min-1
- C、 v(C)=0.02 mol·L-1·s-1
- D、 v(D)=0.12 mol·L-1·min-1
试题详情
工业炼铁是在高炉中进行的,高炉炼铁的主要反应是:① ;②
;② 。该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需。其主要原因是( )
。该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需。其主要原因是( )
- A、
过量
- B、
与铁矿石接触不充分
- C、 炼铁高炉的高度不够
- D、 上述反应有一定的限度
试题详情
关于有效碰撞理论,下列说法不正确的是( )。
- A、 相同条件下活化分子百分数越多,有效碰撞次数越多,反应速率越快
- B、 一般情况下,正、逆反应的活化能越小反应速率越快
- C、 增大压强提高活化分子百分数,反应速率增大
- D、 催化剂降低反应所需活化能,提高活化分子百分数反应速率增大
试题详情
已知可逆反应A2(g)+B2(g)  2AB(g)的能量变化如图所示,则下列叙述中不正确的是( )。
2AB(g)的能量变化如图所示,则下列叙述中不正确的是( )。
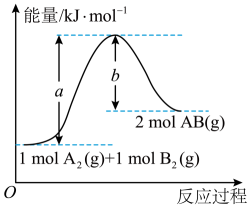
- A、 该反应的活化能为a kJ·mol-1
- B、 该反应的逆反应的活化能为b kJ·mol-1
- C、 该反应的ΔH=+(a-b) kJ·mol-1
- D、 使用催化剂,a的数值减小,ΔH也减小
试题详情
在一定温度下的密闭容器中,不能说明可逆反应H2(g)+I2(g)=2HI(g)已经达到平衡的标志是( )。
- A、 HI的生成速率与HI的分解速率相等
- B、 HI的生成速率与H2的生成速率之比是2∶1
- C、 单位时间内一个H−H键断裂的同时有两个H−I键断裂
- D、 单位时间里断裂2n mol HI的同时生成nmol I2
试题详情
以Fe3O4为原料炼铁,主要发生如下反应:
反应Ⅰ:Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) ΔH1>0
反应Ⅱ:Fe3O4(s)+4CO(g) = 3Fe(s)+4CO2(g) ΔH2
将一定体积CO通入装有Fe3O4粉末的反应器,其它条件不变,反应达平衡,测得CO
的体积分数随温度的变化关系如图所示。下列说法正确的是
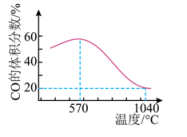 ( )
( )
- A、 ΔH2>0
- B、 反应温度较低时,Fe3O4主要还原产物为Fe
- C、 1040℃时,反应I的化学平衡常数K=0.25
- D、 在恒温、恒容条件下,当容器压强保持不变,反应Ⅰ、Ⅱ均达到平衡状态
试题详情
在某容积可变的密闭容器中加入等量的A、B混合气体共4mol,发生反应: , 保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:
, 保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:
压强p/Pa | ||||
0.08 | 0.20 | 0.40 | 0.80 |
下列说法一定正确的是
- A、 保持一定温度,增大压强,平衡一定正向移动
- B、 当压强为
时,此反应的平衡常数表达式:
- C、 反应平衡后若增大压强,v(正)、v(逆)速率一定增大
- D、 若再向体系中加入一定量的B,当重新达到平衡时,体系中A、B、C总物质的量不变
多选题
试题详情
某小组利用硫代硫酸钠溶液与稀硫酸反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,探究反应条件对速率的影响,下列有关说法正确的是( )
选项 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
② | 25 | 5 | 0.1 | 10 | 0.1 | X |
③ | 50 | 10 | 0.1 | 5 | 0.2 | 5 |
试题详情
向绝热恒容密闭容器中通入SO2和NO2 , 一定条件下使反应SO2(g)+NO2(g)  SO3(g)+NO(g)达到平衡,在此过程中正反应速率随时间变化的曲线如图所示。由图得出的结论正确的是
SO3(g)+NO(g)达到平衡,在此过程中正反应速率随时间变化的曲线如图所示。由图得出的结论正确的是

试题详情
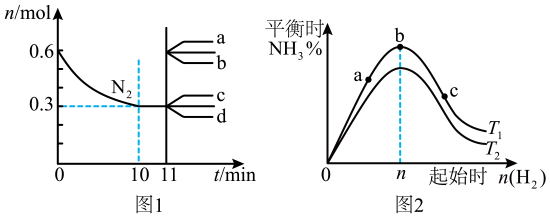
合成氨反应为: 。图1表示在2L的密闭容器中反应时
。图1表示在2L的密闭容器中反应时 的物质的量随时间的变化曲线。图2表示在其他条件不变的情况下,改变起始时氢气的物质的量对此反应平衡的影响。下列说法正确的是( )
的物质的量随时间的变化曲线。图2表示在其他条件不变的情况下,改变起始时氢气的物质的量对此反应平衡的影响。下列说法正确的是( )
试题详情
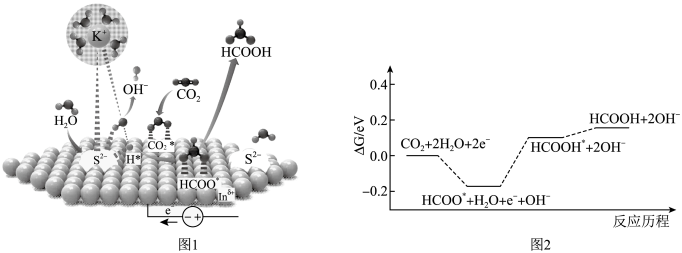
将 电催化转化成燃料和化学品具有重要意义。甲酸可以作为氢载体直接用于甲酸燃料电池。某科学家在常温下用
电催化转化成燃料和化学品具有重要意义。甲酸可以作为氢载体直接用于甲酸燃料电池。某科学家在常温下用 催化剂电催化还原
催化剂电催化还原 制甲酸的机理如图1所示,反应历程如图2所示,其中吸附在催化剂表面的物种用标注。下列说法错误的是( )
制甲酸的机理如图1所示,反应历程如图2所示,其中吸附在催化剂表面的物种用标注。下列说法错误的是( )