选择题
| 选项 | 颜色变化 | 解释 |
| A | 溶液呈浅棕色 |
|
| B | 溶液颜色加深 | 发生了反应: |
| C | 紫黑色晶体消失 |
|
| D | 溶液褪色 |
|
- A、 A
- B、 B
- C、 C
- D、 D

- A、
- B、 可计算
键能为
- C、 相同条件下,
的平衡转化率:历程Ⅱ>历程Ⅰ
- D、 历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:

CO的选择性 , 下列说法正确的是( )
- A、 图中曲线①表示平衡时
产率随温度的变化
- B、 升高温度,平衡时CO的选择性增大
- C、 一定温度下,增大
可提高乙醇平衡转化率
- D、 一定温度下,加入
或选用高效催化剂,均能提高平衡时
产率
选项 | 证据 | 推理 |
A | 室温下,用pH试纸分别测定浓度均为0.1mol•L-1的Na2SO3和NaHSO3两种溶液的pH,Na2SO3溶液的pH更大 | HSO |
B | 将充满NO2的密闭玻璃球浸泡在热水中,红棕色变深反应 | 2NO2(g) |
C | 向淀粉溶液中加入稀硫酸,水浴加热后,再加入银氨溶液,水浴加热,未出现银镜 | 淀粉未发生水解 |
D | 向浓度均为0.01mol•L-1的NaCl和KI混合溶液中滴加少量0.01mol•L-1的AgNO3溶液,出现黄色沉淀 | 说明:Ksp(AgI)>Ksp(AgCl) |
- A、 A
- B、 B
- C、 C
- D、 D
选项 | 事实 | 解释或结论 |
A | 苯不能使酸性高锰酸钾溶液褪色 | 苯分子中含有大π键而没有碳碳双键,大π键稳定性较强 |
B |
|
|
C | 键角: | 水分子中O的孤电子对数比氨分子中N的多 |
D | 取2mL 0.5 |
|
- A、 A
- B、 B
- C、 C
- D、 D

- A、
- B、 温度升高,
分解率增大,
体积分数增大
- C、 向平衡体系中充入惰性气体,平衡向右移动
- D、 其他条件相同,
体积分数越大,
平衡转化率越小

- A、 该反应的
- B、 加入催化剂可以提高CO的平衡转化率
- C、 工业选择的较适宜温度范围为280~290℃
- D、 该反应伴随有副反应的发生

- A、 图甲中W2>1
- B、 图乙中,A线表示逆反应的平衡常数
- C、 温度为T1 , W=2时,Cl2的转化率为50%
- D、 若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强增大

- A、 升高温度,该反应的平衡常数将增大
- B、 从反应开始到达到平衡,逆反应速率先增大后减小
- C、 体系压强不再变化,说明反应达到平衡
- D、 从容器中分离出少量
后,
增加,
减小,平衡正向移动
反应I
反应Ⅱ
在恒容密闭容器内,充入1mol 和3mol
, 测得平衡时
转化率,CO和
选择性随温度变化如图所示[选择性
]。

下列说法正确的是
- A、 270℃时主要发生反应Ⅱ
- B、 230℃下缩小容器的体积,n(CO)不变
- C、 250℃下达平衡时,
- D、 其他条件不变,210℃比230℃平衡时生成的
多
反应I: CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H1=-53.7kJ·mol-1
反应II:CO2(g) + H2(g)= CO(g) + H2O(g) △H2=+41kJ·mol-1
若仅考虑上述反应,在5.0 MPa、n始(CO2): n始(H2)=1:3时,原料按一定流速通过反应器,CO2的转化率和CH3OH的选择性随温度变化如图所示。CH3OH的选择性=

下列说法正确的是
- A、 其他条件不变,升高温度,CO2的平衡转化率增大
- B、 其他条件不变,T>236℃时,曲线下降的可能原因是反应1正反应程度减弱
- C、 一定温度下,增大n始(CO2):n始(H2)可提高CO2平衡转化率
- D、 研发高温高效催化剂可提高平衡时CH3OH的选择性
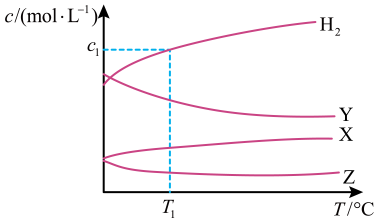
下列说法正确的是
- A、 该反应的平衡常数随温度升高而增大
- B、 曲线Y表示
随温度的变化关系
- C、 提高投料比
, 可提高
的平衡转化率
- D、 其他条件不变,
与
在
℃下反应,达到平衡时

- A、 A,D两点对应状态的正反应速率大小关系:v(A)>v(D)
- B、 A,B,C,D,E各点对应状态中,v(正)<v(逆)的是E
- C、 维持
不变,E→A所需时间为
, 维持
不变,D→C所需时间为
, 则
- D、 欲使C状态沿平衡曲线到达A状态,从理论上,可由
无限缓慢降压至
达成
多选题
容器 | 起始物质的量/mol | 平衡 转化率 | |||
CO | H2 | (CH3)2O | CO2 | CO | |
Ⅰ | 0.3 | 0.3 | 0 | 0 | 50% |
Ⅱ | 0.3 | 0.3 | 0 | 0.1 | |
Ⅲ | 0 | 0 | 0.2 | 0.4 | |

下列说法正确的是( )
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )

下列说法错误的是( )

下列说法正确的是( )
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10﹣2 | 2.4×10﹣4 | 1×10﹣5 |
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
① | 387 | 0.20 | 0.080 | 0.080 |
② | 387 | 0.40 | ||
③ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 将装有 | 冷水中烧瓶内气体颜色变浅,热水中烧瓶内气体颜色加深 | 升高温度,化学平衡向吸热方向移动,降低温度,向放热方向移动 |
B | 在两个烧杯中分别盛有等体积、等浓度的烧碱溶液和氨水,插入电极,连接灯泡,接通电源,分别进行导电实验 | 盛有烧碱溶液的灯泡亮度大 | 强电解质导电能力大于弱电解质 |
C | 向盛有 | ①中溶液变蓝,②中产生黄色沉淀 | 溶液中存在平衡: |
D | 用pH试纸分别测定等物质的量浓度的 | pH: | 酸性: |
非选择题
Ⅰ:
Ⅱ:
请回答:
反应Ⅰ:
反应Ⅱ:
回答下列问题:

反应I:
已知:
反应II: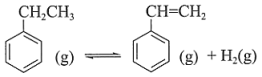
反应III:
回答下列问题:
I.(主反应)
II.(副反应)
请回答:
已知:
反应Ⅰ
反应Ⅱ
反应Ⅲ


