选择题
- A、 pH=1的溶液:Fe2+、Mg2+、
、
- B、 pH=12的溶液:K+、Na+、
、
- C、 pH=7的溶液:Na+、Cu2+、S2-、Cl-
- D、 pH=7的溶液:Al3+、K+、Cl-、
| 粒子组 | 判断和分析 | |
| A | | 不能大量共存,因发生反应: |
| B | | 不能大量共存,因发生反应: |
| C | | 能大量共存,粒子间不反应 |
| D | | 能大量共存,粒子间不反应 |
- A、 A
- B、 B
- C、 C
- D、 D
- A、
、Na+ 、Ba2+、
- B、 K+、Mg2+ 、Cl- 、
- C、
、
、
、Na+
- D、
、Cl- 、
、K+
- A、 溶液中可能含有Fe2+
- B、 溶液中一定含有NO
- C、 溶液中可能含有CO
- D、 溶液中一定不含Al3+
- A、 该溶液中K+、Fe2+、C6H5OH、Br-可以大量共存
- B、 和KI溶液反应的离子方程式:Fe3++2I-=Fe2++I2
- C、 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42—+Ba2++3OH-=Fe(OH)3↓+ BaSO4↓
- D、 1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
多选题
①一份固体溶于水得透明溶液,加入足量BaCl2溶液,得白色沉淀6. 63 g,在沉淀中加入过量稀盐酸,仍有4. 66g白色沉淀。
②另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0. 672 L(标准状况)。
下列说法正确的是( )
 下列说法错误的是( )
下列说法错误的是( )
非选择题

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 | Fe3+ | Fe2+ | Ni2+ | Cu2+ |
开始沉淀的pH | 1.9 | 7.0 | 6.4 | 5.4 |
完全沉淀的pH | 3.2 | 9.0 | 8.4 | 6.7 |
回答下列问题:
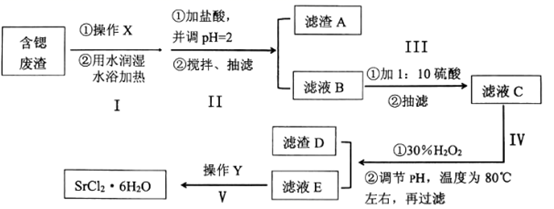
已知:①SrSO4微溶于水;
②SrCl2•6H2O在61.5℃以上即会失去4个结晶水生成SrCl2•2H2O。

阳离子 |
|
阴离子 |
|
实验Ⅰ:取少量该强酸性溶液A进行如图1实验。
实验Ⅱ:为了进一步确定该溶液的组成,取100mL原溶液A,向该溶液中滴加的
溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图2所示。


回答下列问题:
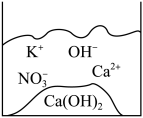
①用铂丝蘸取少量该溶液置于无色酒精灯火焰中灼烧,火焰呈黄色;
②取少量该溶液加入溶液有白色沉淀生成,过滤,往沉淀中加入足量盐酸后,沉淀部分溶解,并有气体生成;
③在滤液中滴加溶液,产生白色沉淀。
由此推断,该溶液中肯定含有的离子为,肯定不含有的离子为,可能含有的离子为。
①第一份加入AgNO3溶液有沉淀产生。
②第二份加足量NaOH溶液加热后,收集到气体0.04mol。
③第三份加足量BaCl2溶液后,得干燥沉淀8.6g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验数据,填写下列空白。
| 阳离子 | |
| 阴离子 | |
已知
①A溶液呈碱性;
②实验室常用B的浓溶液制取化工原料氯气;
③B溶液与C溶液混合有白色沉淀产生;
④向D溶液中逐滴滴加A溶液至过量,有白色沉淀产生,且沉淀量先增加后减少但不消失。
回答下列问题: