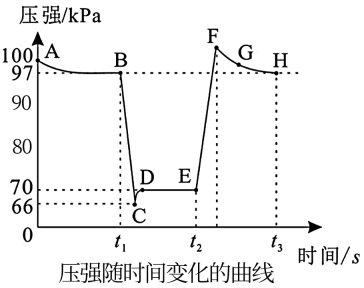
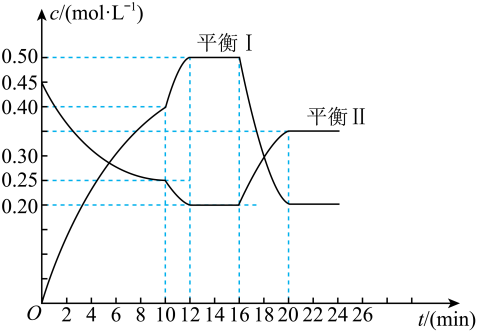
选择题
已知:图
中曲线表示
体系中各含碳粒子的物质的量分数与
的关系。
图
中曲线Ⅰ的离子浓度关系符合
;曲线Ⅱ的离子浓度关系符合
注:起始
, 不同
下
由图
得到
。
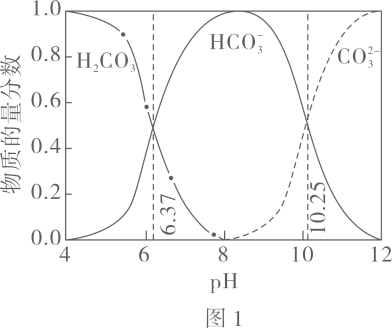
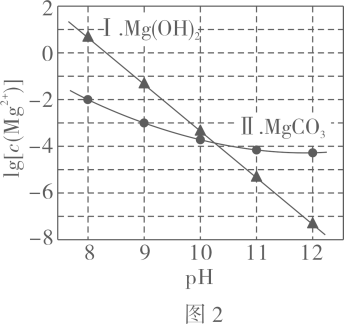
下列说法不正确的是( )
- A、 由图
,
- B、 由图
, 初始状态
, 无沉淀生成
- C、 由图
, 初始状态
, 平衡后溶液中存在
- D、 由图
和图
, 初始状态
、
, 发生反应:

- A、 该反应正反应为放热反应
- B、 曲线①,0~50min用
表示的平均反应速率为
- C、 曲线②,可能使用了催化剂或压缩容器体积
- D、 曲线③,达到平衡后,容器内各物质的浓度分别增加
, 平衡正向移动

- A、 该反应正反应为放热反应
- B、 曲线①,0~50min用
表示的平均反应速率为
- C、 曲线②,可能使用了催化剂或压缩容器体积
- D、 曲线③,达到平衡后,容器内各物质的浓度分别增加
, 平衡正向移动

- A、 0℃时,
的溶解度约为
- B、 对海水进行冷冻,可获取淡水资源
- C、 由饱和
溶液中析出的晶体是否带结晶水主要由结晶速率决定
- D、 5℃时,取适量20%的
溶液于洁净试管中,用玻璃棒刮擦试管内壁后无明显现象

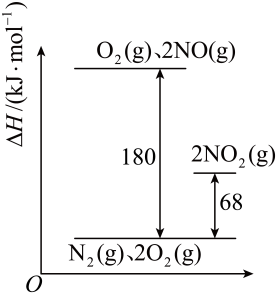
- A、 上述反应的正反应在高温下才能自发进行
- B、 曲线b表示的是φ(N2)随时间的变化
- C、 2v正(NO)=v逆(N2)时,反应达平衡状态
- D、 气体的平均相对分子质量:M(t1)>M(t3)>M(t5)

- A、 X为
对应直线,
- B、 M为向
溶液中滴加NaOH溶液对应的曲线
- C、 图1中a点对应的溶液为
的不饱和溶液
- D、 图2中c点、b点对应取值分别为
,
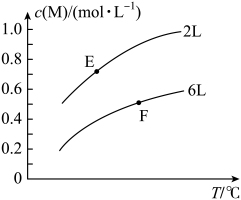
- A、 a> m十n
- B、 Q>0
- C、 E点的平衡常数大于F点的平衡常数
- D、 达到平衡后,增大Y的量将会提高X的转化率

下列说法错误的是( )
- A、 反应①的活化能比反应②的活化能大
- B、
内,Z的平均反应速率为
- C、 反应
时,
- D、
时Y的浓度为

- A、
- B、 曲线a表示[Cu(NH3)4]2+的物质的量分布分数曲线
- C、 lgc(NH3)=-3时,c(Cu2+)+c{[Cu(NH3)]2+}+ c{[Cu(NH3)2]2+}+ c{[Cu(NH3)3]2+}+ c{[Cu(NH3)4]2+}=0.5[c(OH-)-c(H+)-c(
)]
- D、 M点时,
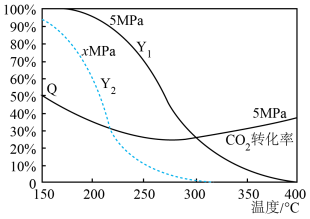
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-58.6kJ·mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) △H=41.2kJ·mol-1
0.5MPa下,将n(H2):n(CO2)=3的混合气体以一定流速通过装有催化剂的反应器,测得CO2的转化率、CH3OH或CO的选择性[×100%]以及CH3OH的收率(CO2的转化率×CH3OH的选择性)随温度的变化如图所示。下列说法正确的是( )

- A、 CO(g)+2H2(g)=CH3OH(g) △H=99.8kJ·mol-1
- B、 曲线a表示CH3OH的选择性随温度的变化
- C、 图中所示270℃时,对应CO2的转化率为21%
- D、 在210℃~250℃之间,CH3OH的收率增大是由于CH3OH的选择性增大导致
多选题
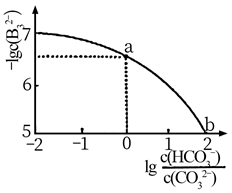




反应Ⅰ 2CH3I(g)C2H4(g)+2HI(g)
反应Ⅱ 3C2H4(g)2C3H6(g)
反应Ⅲ 2C2H4(g)C4H8(g)
向容积为1L的密闭容器中起始投入1molCH3I(g),反应温度对平衡体系中乙烯、丙烯和丁烯占所有气体物质的量分数的影响如图所示。已知715K时,CH3I的转化率为80%。

下列说法正确的是( )

非选择题
Ⅰ:
Ⅱ:
请回答:

已知:①
②
i.2NO2(g)+2OH-(aq)= (aq)+NO2(aq)+H2O(1)|
ii.N2(g)+3H2(g)=2NH3(g)
反应I: CO2(g) +3H2(g)CH3OH(g) +H2O(g) ΔH1 = -49.6 kJ·mol-1
反应: II.CO2(g) +H2(g)CO(g) +H2O(g) ΔH2= + 41.2 kJ·mol-1
当原料组成为n(CO2):n(H2)=1:3时,上述反应体系在一定条件下建立平衡后,含碳产物中CH3OH的物质的量分数(Y)及CO2的转化率(Q )与反应温度的关系曲线如图所示。

回答下列问题:
I.2CH4(g)C2H2(g)+3H2(g) ΔH1=+376.6kJ·mol-1;
II.CH4(g)C(s)+2H2(g) ΔH2=+75kJ·mol-1;
III.CO2(g)+C(s)2CO(g) ΔH3=+172kJ·mol-1;
IV.CO2(g)+H2(g)CO(g)+H2O(g) ΔH4=+41kJ·mol-1。
回答下列问题:






