选择题
试题详情
X、Y、Z、M、Q五种短周期主族元素,原子序数依次增大。X的核外电子数等于其周期数, 分子呈三角锥形,Z的核外电子数等于X、Y核外电子数之和。M与X同主族,Q是同周期中非金属性最强的元素。下列说法正确的是( )
分子呈三角锥形,Z的核外电子数等于X、Y核外电子数之和。M与X同主族,Q是同周期中非金属性最强的元素。下列说法正确的是( )
- A、 X与Z形成的10电子微粒有2种
- B、 Z与Q形成的一种化合物可用于饮用水的消毒
- C、
与
的晶体类型不同
- D、 由X、Y、Z三种元素组成的化合物的水溶液均显酸性
试题详情
X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素的最高正价为  价,Y元素与Z、M元素相邻,且与M元素同主族;化合物
价,Y元素与Z、M元素相邻,且与M元素同主族;化合物  的电子总数为18个;Q元素的原子最外层电子数比次外层少一个电子。下列说法错误的是( )
的电子总数为18个;Q元素的原子最外层电子数比次外层少一个电子。下列说法错误的是( )
- A、 原子半径:
- B、 最高价氧化物对应水化物的酸性:
- C、
易溶于水,其水溶液呈碱性
- D、 X、Z和Q三种元素形成的化合物一定是共价化合物
试题详情
W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。下列叙述正确的是( )
- A、 非金属性:W> X>Y> Z
- B、 原子半径:Z>Y>X>W
- C、 元素X的含氧酸均为强酸
- D、 Y的氧化物水化物为强碱
试题详情
离子液体是室温下呈液态的离子化合物。由原子序数依次增大的短周期主族元素X、Y、Z、W、R组成的一种离子液体的结构如图所示,W的简单氢化物易液化,可用作制冷剂,R的简单阴离子含10个电子。下列说法正确的是

- A、 电负性:R>X>Z
- B、 氢化物的沸点:R>Z
- C、 分子YR3的空间构型为三角锥形
- D、 最高价含氧酸的酸性:W>Z
试题详情
我国科学家在寻找“点击反应”的砌块过程中,发现一种新的化合物,结构如下图所示,其中X、Y、Z和W是原子序数依次增大的短周期主族元素,Y与W是同一主族元素。下列说法正确的是

- A、 元素电负性:Z>Y>W
- B、 简单氢化物沸点:X>Y>W
- C、 简单离子半径:Z>Y>X
- D、 X、W氧化物的水化物均为强酸
试题详情
W、X、Y、Z、M、N为六种短周期主族元素。W的核外电子数等于其周期数,X、Y、Z是原子序数依次增大的同周期元素且W2Z是最常用的溶剂。W、X、Y、Z的最外层电子数之和与N的质子数相等。只有M是金属元素。下列说法正确的是
- A、 由W、Y、Z三种元素组成的化合物可能是强电解质
- B、 氢化物的沸点:Z>N>X
- C、 离子半径:N>M>Z>Y
- D、 W和M形成的化合物溶于水显酸性
试题详情
某种由六种元素形成的抗癌药物的结构简式如图所示,其中W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y同主族,Y、Z的最外层电子数之和是X的最外层电子数的2倍,下列叙述错误的是

- A、 W的最简单氢化物与Z的单质混合后可产生白烟
- B、 简单气态氢化物稳定性:X<W
- C、 WZ3中各原子均满足8电子稳定结构
- D、 X的一种单质和化合物ZX2均可用于杀菌消毒
试题详情
短周期主族元素W、X、Y、Z、Q原子序数依次增大。W与Q同主族,且Q的原子序数是W的2倍;X的简单离子在同周期元素形成的简单离子中半径最小。下列说法正确的是
- A、 元素最高正价:W = Q
- B、 原子半径:W>X
- C、 核外未成对电子数:Y = Q
- D、 非金属性:Y>Z
试题详情
通过比较与归纳可以加深对化学物质的认识。下列说法一定正确的是
- A、 热稳定性:NH3>PH3>H2S
- B、 酸性:HClO4>H2SO4>H3PO4
- C、 离子半径:阴离子>阳离子
- D、 熔沸点:离子化合物>共价化合物
试题详情
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外p能级上的电子总数与s能级上的电子总数相等,Y原子核外没有未成对电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是
- A、 简单离子半径X的比Y的小
- B、 Y的第一电离能比同周期相邻两种元素的大
- C、 Z的常见氧化物是一种离子晶体
- D、 W的简单氢化物是非极性分子
试题详情
化合物A主要用作磷化铝中间体,也用于医药,其结构如图所示。已知:W、X、Y、Z为四种短周期主族元素,原子序数依次增大,Z的某种单质是生命活动中不能缺少的物质,下列说法错误的是
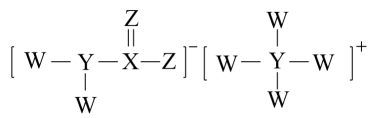
- A、 原子半径:
- B、 化合物A中Y显
价
- C、 简单氢化物稳定性:
- D、 由W、Y、Z三种元素组成的化合物一定抑制水的电离
试题详情
主族元素X、Y、Z、W分别位于三个短周期,且原子序数依次增大。X、Y可形成化合物A的结构式为:X-Y-Y-X;Y、Z、W可形成具有强氧化性的化合物B,其电子式为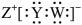 。下列说法错误的是( )
。下列说法错误的是( )
- A、 原子半径:Z>Y>X
- B、 W的最高价氧化物的水化物为强酸
- C、 B的浓溶液可用pH试纸测其酸碱性
- D、 化合物A、B都可用作新型冠状病毒的消毒剂
试题详情
短周期主族元素X、Y、Z、W在周期表中的位置如图所示,其中X、W最低负化合价之和为-4,下列说法错误的是( )
Y | Z | |
X | W |
- A、 原子半径: X>Y
- B、 单质的熔点: X> W
- C、 X与W只能形成一种化合物
- D、 简单氢化物的稳定性: Z> W
试题详情
硒代半胱氨酸(含C、H、N、O、34Se5种元素)是一种氨基酸,其分子空间结构如图,下列说法错误的是

- A、 Se位于元素周期表中第四周期VIA族
- B、 图中最大的球代表Se
- C、 硒代半胱氨酸分子中含一个手性碳原子
- D、 硒代半胱氨酸难溶于水,易溶于苯
试题详情
W、X、Y、Z为原子序数依次增大的短周期主族元素,W、Z同主族,Y单质可用作光电池,X的周期序数等于主族序数,Z原子的最外层电子数等于最内层电子数的3倍,下列叙述错误的是
- A、 工业上采用熔融电解法冶炼X的单质
- B、 含X或Y的某些盐可用于制备胶体
- C、 简单离子的半径:Z>W>X
- D、 YW2和ZW2都是酸性氧化物,都不与酸反应
试题详情
如图是人体含量较多元素的质量分数图,下列有关这些元素的说法错误的是

- A、 原子半径:N<P
- B、 第一电离能:K>Ca
- C、 基态O原子的价层电子轨道表示式
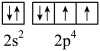
- D、 图中的七种元素中有2种元素位于周期表第4周期
试题详情
短周期主族元素X、Y、Z原子序数依次增大,可与C、H形成结构如图的离子液体。已知阳离子中的环状结构与苯类似,下列说法错误的是
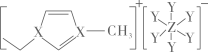
- A、 原子半径:Z>X>Y
- B、 第一电离能:Y>X>Z
- C、 阳离子中存在π
大π键
- D、 X2Y2电子式:
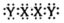
试题详情
“证据推理与模型认知”是化学学科培养的核心素养之一。下列推论合理的是( )
| 选项 | 已知信息 | 推论 |
| A. | 原子半径: | 离子半径: |
| B. | 非金属性: | 还原性: |
| C. | 酸性: | 酸性: |
| D. |
| 二甲醚的分子骨架( |
- A、 A
- B、 B
- C、 C
- D、 D
试题详情
前四周期主族元素X、Y 、Z、W的原子序数依次增大,它们形成的一种物质的结构如图所示,其中所有原子都形成了8电子稳定结构,四种元素中仅X、Y在同周期。下列推断中错误的是
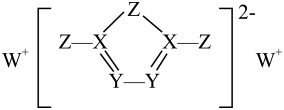
- A、 简单离子半径:W> Z> Y
- B、 Z单质可溶于由X、Z形成的化合物中
- C、 第一电离能:Y> X
- D、 Y与氧元素形成的化合物不止三种
多选题
试题详情
X、Y、Z、Q、W是原子序数依次增大的前四周期元素,其中X是宇宙中含量最多的元素;在同周期元素中,第一电离能数值比Y大的元素有2种;Z元素原子的价层电子排布是 ;Q、W元素原子的最外层均只有1个电子,但Q元素原子中只有两种形状的电子云,W元素原子的次外层内的所有轨道的电子均成对。下列说法正确的是( )
;Q、W元素原子的最外层均只有1个电子,但Q元素原子中只有两种形状的电子云,W元素原子的次外层内的所有轨道的电子均成对。下列说法正确的是( )
试题详情
下列操作能达到实验目的的是( )
| 选项 | 目的 | 操作 |
| A | 除去Cu粉中混有的CuO | 加入稀硝酸,过滤、洗涤、干燥 |
| B | 探究温度对Fe3+水解程度的影响 | 向25 mL冷水和沸水中分别滴入5滴饱和FeCl3溶液,比较溶液颜色 |
| C | 证明甲苯中的甲基能够活化苯环 | 分别取甲苯和苯与酸性KMnO4溶液反应,观察酸性KMnO4溶液的褪色情况 |
| D | 证明非金属性:Cl>S | 向Na2S溶液中滴加新制氯水,观察实验现象 |
非选择题
试题详情
冰壶比赛称为“冰上的国际象棋”,制作冰壶用的标准砥石的化学成分为石英碱长正长岩,常见的组分有钾长石K[AlSi3O8]和钠长石Na[AlSi3O8]等。完成下列填空:
试题详情
吴梦昊研究团队设计了一系列稳定的由超碱PnH  和超卤素MX
和超卤素MX  组成的PnH4MX4(Pn=N,P;M=B,Al,Fe;X=Cl,Br)超盐晶体。
组成的PnH4MX4(Pn=N,P;M=B,Al,Fe;X=Cl,Br)超盐晶体。
试题详情
钛及其化合物在工业、医疗、航天等多方面都有广泛的应用,越来越受到人们的关注。
试题详情
明代科学家宋应星在《天工开物》中写道:“凡玉入中国,贵者尽出于田、葱岭”。和田玉的主要化学成分是含水的钙镁硅酸盐。回答下列问题:
试题详情
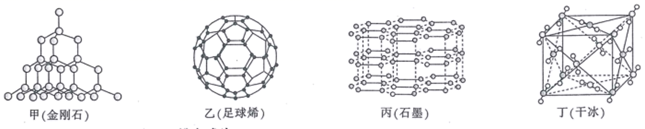
第IVA族元素及其化合物是结构化学研究的热点。几种晶体结构如图所示:
试题详情
硒是稀散非金属之一,在光敏材料、电解锰行业催化剂和半导体材料等方面有广泛应用,其在元素周期表中相对位置关系如图所示:

回答下列问题:
试题详情
寻找室温超导材料一直是科学家们竞相追求的目标, CaFeAsF 、LaH10、H2S等均是近年来的研究热点。回答下列问题:
试题详情
化学工业为疫情防控提供了强有力的物质支撑。氯及其化合物既是重要化工原料,又是广泛使用的高效灭菌消毒剂。回答下列问题:
试题详情
X、Y、L、M、N为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、M与N三种元素的质子数均为5的倍数,Y与L同主族。回答下列问题:
试题详情
已知A、B、C、D、E、F为前4周期的6种元素,原子序数依次增大,其中A位于周期表中s区,其原子中电子层数和未成对电子数相同;B原子价电子排布式为nsnnpn , B和E同主族,D原子的最外层电子数是其内层电子数的3倍;F元素位于元素周期表的第4行、第11列。试回答下列问题:


