选择题
试题详情
物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
| 选项 | 性质差异 | 结构因素 |
| A | 沸点:正戊烷(36.1℃)高于新戊烷(9.5℃) | 分子间作用力 |
| B | 熔点: | 晶体类型 |
| C | 酸性: | 羟基极性 |
| D | 溶解度(20℃): | 阴离子电荷 |
- A、 A
- B、 B
- C、 C
- D、 D
试题详情
甲酸 是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分
是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分 , R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始
, R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始 关系如图(已知甲酸
关系如图(已知甲酸 ),下列说法错误的是
),下列说法错误的是
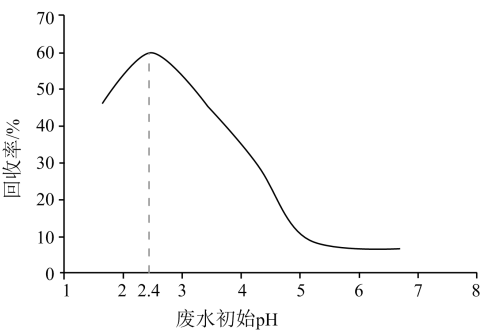
- A、 活性成分
在水中存在平衡:
- B、
的废水中
- C、 废水初始
, 随
下降,甲酸的电离被抑制,与
作用的
数目减少
- D、 废水初始
, 离子交换树脂活性成分主要以
形态存在
试题详情
下图是亚砷酸As(OH)3和酒石酸 混合体系中部分物种的c-pH图(浓度:总As为
混合体系中部分物种的c-pH图(浓度:总As为 , 总T为
, 总T为 )。下列说法错误的是( )
)。下列说法错误的是( )

- A、
的
为
- B、
的酸性比
的强
- C、
时,
的浓度比
的高
- D、
时,溶液中浓度最高的物种为
试题详情
常温下,  ,
,  ,
,  , 下列说法不正确的是
, 下列说法不正确的是
- A、 浓度均为0.1 mol/L的HCOONa和
溶液中阳离子的物质的量浓度之和:前者>后者
- B、 用相同浓度的NaOH溶液分别滴定等体积、pH均为3的HCOOH和
溶液至终点,消耗NaOH溶液的体积:前者<后者
- C、 0.2mol/L
与0.1 mol/L盐酸等体积混合后,溶液中微粒浓度:
- D、 0.2mol/L HCOONa溶液与0.1mol/L NaOH溶液等体积混合后的溶液中:
试题详情
用0.1mol/L的NaOH溶液滴定20mL0.1mol/L的CH3COOH溶液时,溶液的温度(I)、pH(II)随NaOH体积的变化如下图(图中虚线为校正至25℃时的pH曲线),V1时溶液中  =1。
=1。

下列说法正确的是
- A、 x点溶液中,CH3COOH电离程度小于CH3COONa的水解程度
- B、 y点溶液中,c(CH3COO-)=c(Na+)>c(H+)= c(OH-)
- C、 w点溶液的碱性强于z点溶液的碱性
- D、 25℃时,CH3COOH的电离常数Ka=1×10-a
试题详情
常温下,用如图所示装置,分别向 溶液和
溶液和
 溶液中逐滴滴加
溶液中逐滴滴加 的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示。下列说法正确的是
的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示。下列说法正确的是
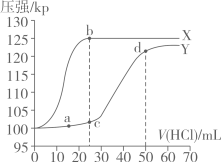
- A、 X曲线为
溶液与盐酸反应的压强变化曲线
- B、 c点的溶液中:
- C、 用pH试纸测得c点的pH约为8,可知:
- D、 a、d两点水的电离程度:
试题详情
室温下,以氟磷灰石 为原料,经酸浸、转化可得到
为原料,经酸浸、转化可得到 、
、 和
和 。已知:25℃,
。已知:25℃, 的
的 、
、 、
、 (
( );下列说法错误的是( )
);下列说法错误的是( )
- A、
的沉淀溶解平衡可表示为:
- B、 酸浸过程中溶液
时,
- C、
溶液中存在:
- D、 向
溶液中加入少量水稀释时,
的值增大
试题详情
下列说法正确的是( )
- A、 在元素周期表中,每一周期都是从碱金属元素开始,以稀有气体元素结束
- B、 弱电解质电离平衡正向移动,则电离程度增大,溶液导电性增强
- C、 难溶电解质的
越大,其溶解度不一定越大
- D、 向平衡体系中加入反应物,则正反应速率增大,平衡正向移动
试题详情
常温下,用 标准溶液滴定
标准溶液滴定 等浓度的三元酸
等浓度的三元酸 , 得到
, 得到 与
与 、
、 或
或 或
或 的关系分别如图1、图2所示。
的关系分别如图1、图2所示。
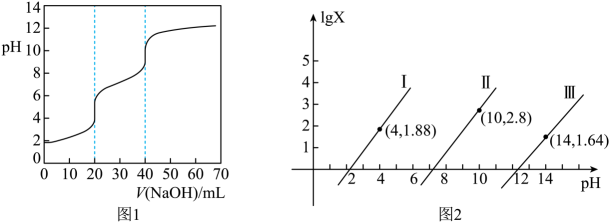
下列说法错误的是( )
- A、 曲线Ⅰ表示
与
的变化关系
- B、 由图1知中和
溶液时,未出现
突跃
- C、 当体系中溶液的
时,
- D、 当滴入
溶液时,
试题详情
HA是一元弱酸,含少量MA固体的难溶盐MA的饱和溶液中c(M+)随c(H+)而变化, M+不发生水解。实验发现,298K 时c2(M+)~ c(H+)为线性关系,如下图中实线所示。下列叙述错误的是

- A、 c(H+) 增大的原因可能是加入了酸HA
- B、 溶液c(H+)= 2×10-4时,c(M+)> 3×10-4mol·L-1
- C、 随着c(H+)的增大, MA的溶度积Ksp(MA)保持不变
- D、 c2(M+)~ c(H+) 的线性关系为: c2(M+)= Ksp(MA)
试题详情
已知常温时 的
的 的
的 , 现将
, 现将 和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,
和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释, 随溶液体积的变化如图所示,下列叙述正确的是
随溶液体积的变化如图所示,下列叙述正确的是

- A、 曲线Ⅱ为氢氟酸稀释时
的变化曲线
- B、 取相同体积a点的两种酸溶液,中和相同浓度的
溶液,
消耗
溶液体积较小
- C、 b点溶液中水的电离程度比c点溶液中水的电离程度小
- D、 从b点到d点,溶液中
的值变小(
代表
或
)
试题详情
常温下,用 溶液滴定
溶液滴定 溶液,消耗
溶液,消耗 溶液的体积与混合液
溶液的体积与混合液 关系如下图所示。滴定过程中有白色沉淀生成,但整个过程未见气泡产生。已知:碳酸
关系如下图所示。滴定过程中有白色沉淀生成,但整个过程未见气泡产生。已知:碳酸 ,
,  ;
; 。下列说法正确的是
。下列说法正确的是

- A、 ab段
升高的主要原因:
- B、 bc段溶液不可能出现白色沉淀
- C、 b点:
- D、 c点:
多选题
试题详情
NaClO溶液具有添白能力,已知25℃时, 。下列关于NaClO溶液说法正确的是( )
。下列关于NaClO溶液说法正确的是( )
试题详情
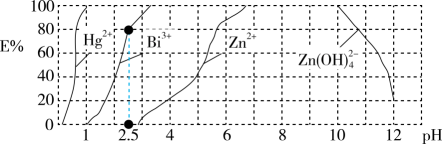
用双硫腺(H2Dz,二元弱酸)~CCl4络合萃取法可从工业废水中提取金属离子,从而达到污水处理的目的。如在分离污水中的Cu2+时,先发生络合反应:Cu2++2H2Dz Cu(HDz)2+2H+ , 再加入CCl4 , Cu(HDz)2就很容易被萃取到CCl4中。如图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率),下列说法错误的是
Cu(HDz)2+2H+ , 再加入CCl4 , Cu(HDz)2就很容易被萃取到CCl4中。如图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率),下列说法错误的是
试题详情
分析化学中“滴定分数”的定义为滴定过程中标准溶液与待测溶液溶质的物质的量之比。常温下用0.01mol·L-1的NaOH溶液滴定0.01mol·L-1某二元弱酸H2R溶液的滴定曲线如图所示。下列说法错误的是

试题详情
常温下,向20 mL 0.1 mol·L-1NaN溶液中滴入等浓度的HM溶液,所得溶液中 与
与 的关系如图所示。已知
的关系如图所示。已知 , 下列说法错误的是
, 下列说法错误的是

试题详情
常温下,将0.2 mol·L⁻¹  溶液与0.2 mol·L⁻¹ NaHA溶液等体积混合所得溶液
溶液与0.2 mol·L⁻¹ NaHA溶液等体积混合所得溶液 。向混合溶液中缓慢通入HCl气体或加入NaOH固体(无
。向混合溶液中缓慢通入HCl气体或加入NaOH固体(无 逸出),溶液中的粒子分布系数
逸出),溶液中的粒子分布系数 随溶液pOH的变化如图所示。
随溶液pOH的变化如图所示。
已知:或
;a、b、c、d、e分别表示
、
、
、
、
中的一种。
。

下列说法错误的是
试题详情
常温下,向某浓度的H2C2O4溶液中缓慢滴加一定浓度的NaOH溶液,所得溶液中H2C2O4、 、
、 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。下列说法正确的是( )
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。下列说法正确的是( )

试题详情
25℃下,用NaOH溶液分别滴定 、
、 两种溶液,
两种溶液, (M=Cu、Fe),pM随pH变化关系如图所示,已知水溶液中
(M=Cu、Fe),pM随pH变化关系如图所示,已知水溶液中 比
比 更难溶。下列说法错误的是( )
更难溶。下列说法错误的是( )

试题详情
室温下,向含1mol N2H4的水溶液中通入HCl气体,溶液的pOH[pOH=-1gc(OH-)]与含氮粒子的分布分数δ(X)(X代表N2H4、N2H 、N2H
、N2H 等粒子)的关系如图所示。下列说法错误的是( )
等粒子)的关系如图所示。下列说法错误的是( )

试题详情
常温下,向二元弱酸 溶液中滴加
溶液中滴加 溶液,测得混合溶液的
溶液,测得混合溶液的 与离子浓度变化的关系如图所示,下列说法错误的是( )
与离子浓度变化的关系如图所示,下列说法错误的是( )

试题详情
实验测得浓度均为0.1mol·L-1的NaOH溶液、CH3COONa溶液和NH4Cl溶液的pH随温度变化的曲线如图所示。下列说法错误的是( )

试题详情
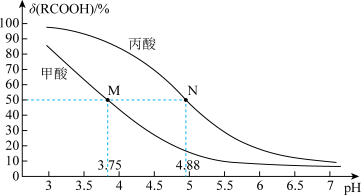
25℃时,改变0.1mol·L-1弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知δ(RCOOH)= ],甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法错误的是( )
],甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法错误的是( )
非选择题
试题详情
天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物 (L为配体)溶于弱碱性的海水中,制成吸收液,将气体
(L为配体)溶于弱碱性的海水中,制成吸收液,将气体 转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①
转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:① 的吸收氧化;②
的吸收氧化;② 的再生。反应原理如下:
的再生。反应原理如下:
①
②
回答下列问题:
试题详情
乙二酸俗称草酸( ),是一种二元弱酸,易溶于水,具有还原性。25℃时,
),是一种二元弱酸,易溶于水,具有还原性。25℃时, 的电离平衡常数
的电离平衡常数 ,
,  。
。
试题详情
非金属元素及其化合物与科研、工农业生产有着密切联系。回答下列问题:
试题详情
硫、氮、氯、氧、钠、铝、铁等是人们熟悉的元素,它们的单质及其化合物对工农业有着很重要的地位。
试题详情
室温下,Ka1(H2SO3)=10-1.81 , Ka1(H2SO3)=10-6.99。室温下通过下列实验探究Na2SO3、NaHSO3溶液的性质。
实验1:测定某浓度的NaHSO3溶液的pH,测得pH为5.2。
实验2:向0.10mol·L-1NaHSO3溶液中加氨水至pH=7。
实验3:向0.10mol·L-1Na2SO3溶液中滴几滴0.10mol·L-1FeCl3溶液,再滴加KSCN溶液,溶液不变红。
实验4:向0.10mol·L-1Na2SO3溶液中加入BaO2固体,有气体产生,同时有白色沉淀。
下列说法错误的是( )
- A、 实验1的溶液中:
=10-1.6
- B、 实验2得到的溶液中有
- C、 实验3中加FeCl3溶液的离子方程式为:
- D、 实验4的上层清液中有c(SO
)•c(Ba2+)=Ksp(BaSO3),产生的气体中一定有SO2
试题详情
硫化氢的转化是资源利用和环境保护的重要研究课题。
试题详情
磷及其化合物与人类生产、生活密切相关。
试题详情
某实验小组利用如图装置模拟古法硫酸生产方法并进行SO2性质探究。

已知A中反应的化学方程式:2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2 , 关闭活塞K3 , 通入一段时间N2后,关闭活塞K1、K2 , 打开活塞K3 , 高温加热绿矾。
完成下列填空:
试题详情
探究含碳化合物的转化,有一定的现实意义。
试题详情
硒是一种重要的半导体材料,用富硒铜阳极泥(主要成分为Se、Cu2Se、Ag2Se和银、金等)为原料制备硒的工艺流程如下:

回答下列问题:


 ,则X可能为P
,则X可能为P
