选择题
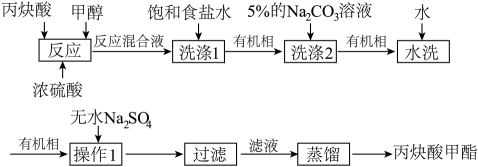
- A、 “蒸馏”时不能用水浴加热
- B、 “操作1”名称为干燥
- C、 “洗涤2”中5%Na2CO3溶液的作用是除去丙快酸等酸性物质
- D、 “反应”前加入试剂的顺序为浓硫酸、丙焕酸、甲醇

已知:25℃草酸和碳酸的电离平衡常数数值如下表。
电离平衡常数 | ||
- A、 过程①微热的目的是加快草酸溶解,同时防止温度过高草酸分解
- B、 过程②中加入的碳酸钾物质的量与草酸物质的量相等时,得到草酸氢钾溶液
- C、 操作③为趁热过滤,操作④为降温结晶、过滤洗涤、干燥
- D、 得到的产品用酒精洗涤优于冷水洗涤
已知:酸性条件下Cu+不稳定
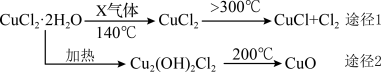
下列说法错误的是
- A、 X气体是HCl,可抑制CuCl2•2H2O加热时水解
- B、 途径1中产生的Cl2可以回收利用,也可以通入饱和NaOH溶液中除去
- C、 途径2中200℃时反应的化学方程式为Cu2(OH)2Cl2
2CuO+2HCl↑
- D、 CuCl与稀硫酸反应的离子方程式为2Cu++4H++SO
=2Cu2++SO2↑+2H2O
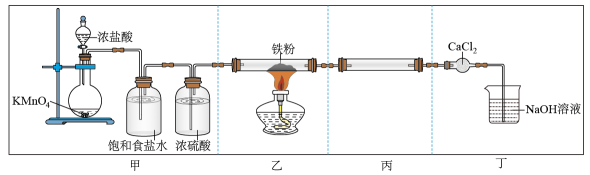
- A、 实验开始,先点燃酒精灯,再滴加浓盐酸
- B、 实验时若不足量,则可能生成
- C、 装置丙的作用是收集
- D、 装置丁中
的作用是吸收未反应的

- A、 装置甲的作用是混合气体、干燥等
- B、 乙处导出的气体主要含有
、
、
- C、 反应生成的
不宜直接通入水中吸收
- D、 工业中用高压提高
的产率

已知:①“酸浸”后为VO2∙xH2O转化为VO2+;
②Cr(OH)3的Ksp近似为1×10-31;下列说法正确的是
- A、 滤渣的成分为H2SiO3
- B、 “氧化”生成
发生反应的离子方程式为2VO3++
+2H2O=2
+2
+4H+
- C、 若“含Cr3+净化液”中c(Cr3+)=0.1mol/L,则“水解沉钒”调pH应不超过10
- D、 “溶液1”中含
, 加入H2O2后发生反应的离子方程式为2
+3H2O2+2OH-=2
+2H++2H2O
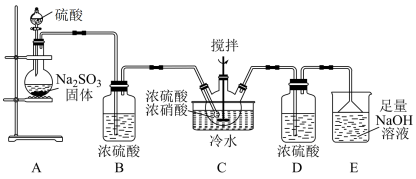
- A、 装置A中应使用70%的浓硫酸
- B、 装置B、D中浓硫酸作用不同
- C、 装置C中反应为
- D、 虚线框内的装置可以换为盛有碱石灰的干燥管
多选题

已知:“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。下列说法正确的是


下列说法正确的是( )
选项 | 实验目的 | 实验操作 |
A | 除去乙醇中的少量乙酸 | 加入适量 |
B | 实验室制备少量 | 在沸腾的蒸馏水中滴加几滴饱和 |
C | 鉴别 | 分别向盛有两种溶液的试管中滴加浓溴水 |
D | 检验淀粉是否水解完全 | 取水解后的混合液,向其中加入新制的 |
非选择题
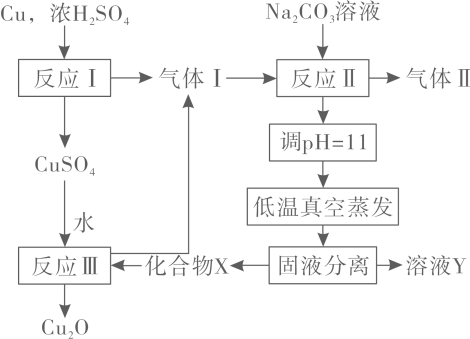
已知:酸性条件下,的氧化性强于
。

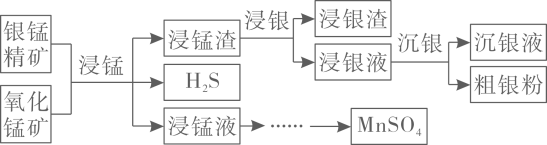
已知:常温下,。相关化合物的溶解度与温度的关系如图所示。

回答下列问题:
已知:①雷尼暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;
②邻硝基苯胺在极性有机溶剂中更有利于反应的进行。
某实验小组制备雷尼并探究其催化氢化性能的实验如下:
步骤1:雷尼的制备
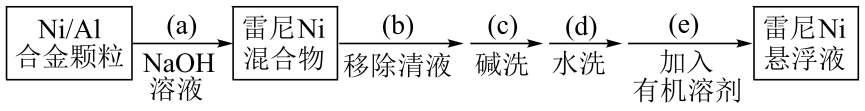
步骤2:邻硝基苯胺的催化氢化反应
反应的原理和实验装置图如下(夹持装置和搅拌装置略)。装置Ⅰ用于储存和监测反应过程。
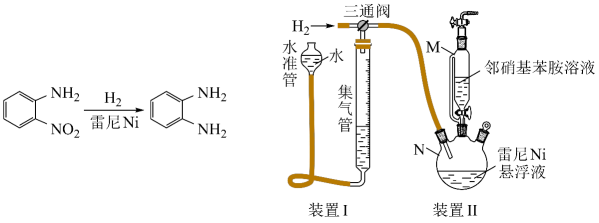
回答下列问题:

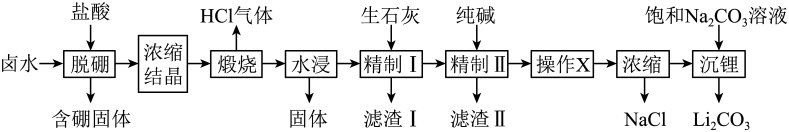
已知:①金属的化学性质和
相似,
的熔点为
;
②(乙醚)和
(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
| 物质 | | | | |
| 沸点/ | 55.7 | 34.6 | 42.4 | 365.8 |
回答下列问题:

回答下列问题:
已知:①含锌组分间的转化关系:
②是
的一种晶型,
以下稳定。
请回答:


已知:金属离子形成氢氧化物沉淀的pH范围[ pH =8.5时Al(OH)3开始溶解]
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ |
开始沉淀时pH | 3.4 | 2.7 | 7.6 | 11.3 |
完全沉淀时pH | 4.7 | 3.7 | 9.6 |
回答下列问题:
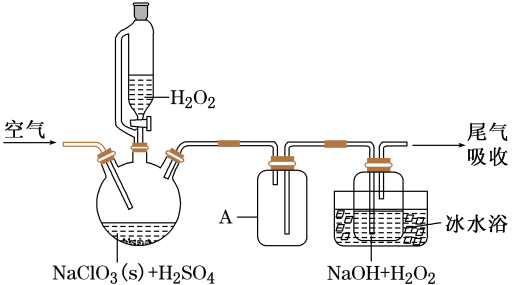
已知:2NaClO3+H2O2+H2SO4=2ClO2 ↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃; H2O2沸点150℃
请回答:

检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝,加热至100℃,通过A加入10mL无水乙醇,观察并记录C中溶液褪色的时间。重复上述实验,分别观察并记录在110℃、120℃、130℃、140℃时C中溶液褪色的时间,实验结果如图所示。

完成下列填空:
I.制备CoCl2
已知:钴单质与氯气在加热条件下反应可制得纯净CoCl2 , 钴单质在300℃以上易被氧气氧化;CoCl2熔点为86℃,易潮解。制备装置如下:
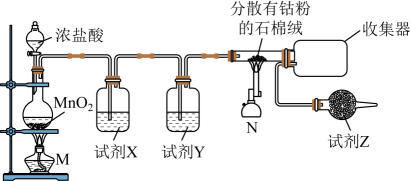

已知:时相关物质的
如下表:
物质 | ||||
回答下列问题:


有关数据如下:
物质 | 苯 | 溴 | 溴苯 |
密度(g· cm-3) | 0.88 | 3.12 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
在水中的溶解性 | 不溶 | 微溶 | 不溶 |
回答下列问题:
![]()
制备流程、实验装置及有关数据如下:
![]()
物质 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139. 4(沸点) | 反应 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |



已知:溶液中金属离子开始沉淀和完全沉淀的浓度及溶液的pH如下表所示:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
开始沉淀时的pH c=0.01mol ·L-1 | 2.2 | 3.7 | 7.5 | 9.6 |
完全沉淀时的pH c=1.0× 10-5mol·L-1 | 3.2 | 4.7 | 9.0 | 11.1 |
试回答下列问题:
i.在锥形瓶中,将溶于水中,加热至沸,加入研细的
晶体,溶解得到混合溶液;
ii.将上述混合液倒入三颈烧瓶中,加入活性炭。冷却,利用如图装置先加入浓氨水,再逐滴加入5% 溶液,水浴加热至50~60℃,保持20min;

iii.然后用冰浴冷却至0℃左右,吸滤,把沉淀溶于50mL沸水中,经操作X后,慢慢加入浓盐酸于滤液中,即有大量橙黄色晶体( ,
)析出;
iv.用冰浴冷却后吸滤,晶体以冷的盐酸洗涤,再用少许乙醇洗涤,吸干。回答下列问题:

已知:
①TiO2+2C+2Cl2TiCl4+2CO
②TiCl4为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应
③PdCl2的盐酸溶液可吸收CO而生成黑色颗粒Pd
回答下列问题:

回答下列问题:

已知一定条件下,部分金属阳离子形成氢氧化物的pH如下表:
离子 | Co3+ | Fe3+ | Co2+ | Fe2+ | Al3+ |
开始沉淀的pH | 0.3 | 2.7 | 7.2 | 7.6 | 3.6 |
完全沉淀的pH | 1.1 | 3.2 | 9.2 | 9.6 | 5.2 |
请回答下列问题:

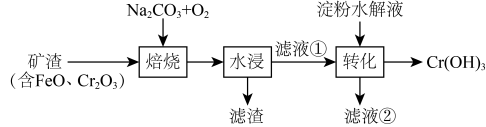

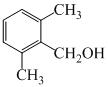 和
和

