选择题
试题详情
下列事实能用平衡移动原理解释的是( )
- A、
溶液中加入少量
固体,促进
分解
- B、 密闭烧瓶内的
和
的混合气体,受热后颜色加深
- C、 铁钉放入浓
中,待不再变化后,加热能产生大量红棕色气体
- D、 锌片与稀
反应过程中,加入少量
固体,促进
的产生
试题详情
某小组进行实验,向 蒸馏水中加入
蒸馏水中加入 , 充分振荡,溶液呈浅棕色,再加入
, 充分振荡,溶液呈浅棕色,再加入 锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知
锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知 为棕色,下列关于颜色变化的解释错误的是
为棕色,下列关于颜色变化的解释错误的是
| 选项 | 颜色变化 | 解释 |
| A | 溶液呈浅棕色 |
|
| B | 溶液颜色加深 | 发生了反应: |
| C | 紫黑色晶体消失 |
|
| D | 溶液褪色 |
|
- A、 A
- B、 B
- C、 C
- D、 D
试题详情
向工业废水中加入硫化物可以获得CuS、FeS纳米粒子[已知 ,
,  ],下列说法正确的是
],下列说法正确的是
- A、 FeS固体不能用于去除工业废水中的
- B、 向
和
混合溶液中加入
溶液,当两种沉淀共存时,
- C、 向CuS饱和溶液中加入
固体,CuS的溶解平衡逆向移动,滤液中一定存在
- D、 已知
溶液中
, 可判断CuS易溶于稀盐酸
试题详情
下列化工生产中,所采取的条件或操作不能用勒夏特列原理解释的是
- A、 工业制盐酸:向合成塔中通入过量氢气
- B、 合成氨:采用20-50MPa压强
- C、 工业制硫酸:向接触室中通入过量空气
- D、 联合制碱工业:向母液中加入食盐
试题详情
一定温度下,向1L密闭容器中充入2molX和1molY,发生反应2X(g)+Y(g)⇌3Z(?)。达到平衡时,容器的压强从原来的P0变为0.4P0。下列说法错误的是
- A、 Z不可能为气体
- B、 达到平衡时容器内有1.8molZ
- C、 压缩体积,再次达到平衡,X的浓度不变
- D、 Y的体积分数不变说明反应达到平衡状态
试题详情
K2Cr2O7溶液中存在多个平衡。在考虑平衡:① (aq) +H2O(l)
(aq) +H2O(l) 2
2 (aq) K1=3.0× 10-2(25℃);②
(aq) K1=3.0× 10-2(25℃);② (aq)
(aq)
 (aq) +H+(aq) K2=3.3× 10-7(25℃)的条件下,25℃时,向0.10 mol/L K2Cr2O7溶液中加入NaOH,溶液中
(aq) +H+(aq) K2=3.3× 10-7(25℃)的条件下,25℃时,向0.10 mol/L K2Cr2O7溶液中加入NaOH,溶液中 , 随pH的变化关系如图所示,溶液体积变化可忽略。下列说法中正确的是
, 随pH的变化关系如图所示,溶液体积变化可忽略。下列说法中正确的是
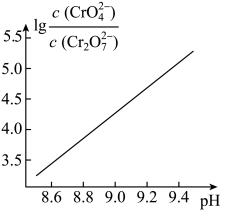
- A、 已知Ka1(H2SO3) = 1.29× 10-2 , 由②可知向K2CrO4溶液中通SO2可制得KHCrO4
- B、
的值随溶液 pH的增大逐渐减小
- C、 当溶液pH=9时,溶液中的
平衡浓度约为6 × 10-4mol/L
- D、 当溶液pH=7时,c(K+) =c (
) +c(
) +2c (
)
试题详情
某元素M的氢氧化物 在水中的溶解反应为:
在水中的溶解反应为: 、
、 ,
,  与
与 的关系如图所示,c为
的关系如图所示,c为 或
或 浓度的值,下列说法错误的是
浓度的值,下列说法错误的是

- A、 曲线②代表
与
的关系
- B、 向
的
溶液中加水稀释,平衡:
逆向移动,
增大
- C、
的
约为
- D、
时,溶液中的
试题详情  的配位化合物较稳定且运用广泛。它可与
的配位化合物较稳定且运用广泛。它可与 、
、 、
、 、
、 等形成配离子使溶液显色。如:显浅紫色的
等形成配离子使溶液显色。如:显浅紫色的 、红色的
、红色的 、黄色的
、黄色的 、无色
、无色 。某同学按如下步骤完成实验:
。某同学按如下步骤完成实验:
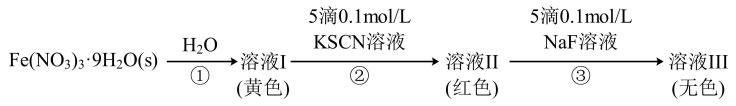
已知与
、
在溶液中存在以下平衡:
(红色);
(无色)
下列说法错误的是
- A、 Ⅰ中溶液呈黄色可能是由
水解产物的颜色引起的
- B、
与
的配位能力强于
- C、 为了能观察到溶液Ⅰ中
的颜色,可向该溶液中加入稀盐酸
- D、 向溶液Ⅲ中加入足量的KSCN固体,溶液可能再次变为红色
试题详情
室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
- A、 加入NaOH,可增大乙醇的物质的量
- B、 将氢溴酸改成NaBr(s)和浓硫酸,可能有利于生成C2H5Br
- C、 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
- D、 若起始温度提高至60℃,可缩短反应达到平衡的时间
试题详情
一定温度下,向三个容积不等的恒容密闭容器中分别投入2 mol NOCl,发生反应:2NOCl(g) 2NO(g)+Cl2(g)。t min后,三个容器中NOCl的转化率如图中A、B、C三点。下列叙述正确的是
2NO(g)+Cl2(g)。t min后,三个容器中NOCl的转化率如图中A、B、C三点。下列叙述正确的是

- A、 A点延长反应时间,可以提高NOCl的转化率
- B、 A、B两点的压强之比为25︰28
- C、 t min时,C点
正<
逆
- D、 容积为a L的容器达到平衡后再投入1 mol NOCl、1 mol NO,平衡不移动
试题详情
难溶盐MA在水中溶解为吸热过程,其沉淀溶解平衡曲线如图所示。下列说法错误的是( )
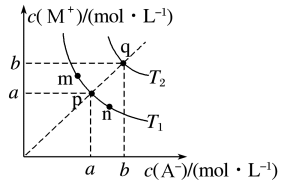
- A、 图中温度
- B、
温度下,
值为
- C、 在
温度下,加适量的NaA固体可使饱和溶液由p点变到n点
- D、 向q点的饱和溶液中滴加NaA溶液,立即析出MA沉淀
试题详情
有平衡体系:CO(g)+2H2(g)⇌CH3OH(g) ΔH <0,为了增加甲醇(CH3OH)单位时间的产量,应采用的最佳措施是( )
- A、 高温、高压
- B、 低温、高压、催化剂
- C、 低温、低压
- D、 适宜温度、高压、催化剂
试题详情
化学知识来源于生活,又能服务于生活。下列叙述正确的是( )
- A、 镀锌的铁皮镀层破损后,铁皮会加速腐蚀
- B、 用
溶液、
溶液分别制取
固体、
固体实验操作完全相同
- C、 利用
的强氧化性既可以对自来水杀菌消毒,又可起到净水的作用
- D、 利用化学平衡移动的原理,可以将煤气中毒的病人移至高压氧舱进行救治
试题详情
在一定条件下的2L密闭容器中,X、Y、C三种气体的物质的量随时间的变化如图所示。下列说法一定错误的是( )

- A、 X、Y、C三种气体发生反应的化学方程式为:
- B、 0~15min,X的平均速率约为0.025
- C、 反应开始到25min,C的产率为25%
- D、 25min时改变的条件可能是降温
试题详情
对于反应2SO2(g)+O2(g)⇌2SO3(g),下列说法正确的是( )
- A、 该反应在任何条件下都能自发进行
- B、 反应达平衡后再通入O2 , SO3的体积分数一定增加
- C、 反应在高温、催化剂条件下进行可提高SO2的平衡转化率
- D、 2mol SO2(g)和1mol O2(g)所含键能总和比2mol SO3(g)所含键能小
多选题
试题详情
CH4与CO2重整生成H2和CO的过程中主要发生下列反应
在恒压、反应物起始物质的量比 条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是( )

试题详情
在容积为2.0L的恒容密闭容器中充入3.0molCl2和4.0molPCl5 , 473K 时发生反应:PCl5(g)  PCl3(g)+Cl2(g)△H= 92.5 kJ·mol-1 , 各物质的物质的量随时间变化关系如图所示:( )
PCl3(g)+Cl2(g)△H= 92.5 kJ·mol-1 , 各物质的物质的量随时间变化关系如图所示:( )

下列说法正确的是( )
试题详情
烟气中的NO经过O3预处理,再用CaSO3悬浊液吸收去除。预处理时发生反应:NO(g)+O3(g)  NO2(g)+O2(g)。测得:v正=k正c(NO)·c(O3),v逆=k逆c(NO2)·c(O2),k正、k逆为速率常数,受温度影响。向容积均为2L的甲、乙两个密闭容器中充入一定量的NO和O3 , 测得NO的体积分数随时间的变化如图所示。下列说法正确的是( )
NO2(g)+O2(g)。测得:v正=k正c(NO)·c(O3),v逆=k逆c(NO2)·c(O2),k正、k逆为速率常数,受温度影响。向容积均为2L的甲、乙两个密闭容器中充入一定量的NO和O3 , 测得NO的体积分数随时间的变化如图所示。下列说法正确的是( )

试题详情
温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2 , 发生反应:2C(s)+2NO2(g)⇌N2(g)+2CO2(g)反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法正确的是( )

试题详情
在三个容积均为2L的密闭容器中按不同方式投入反应物,发生反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g)ΔH=-akJ·mol-1(a>0)
CO2(g)+H2(g)ΔH=-akJ·mol-1(a>0)
相关反应数据如下:
| 容器 | 容器类型 | 起始温度/ | 起始物质的量/mol | 平衡时H2物质的量/mol | |||
| CO | H2O | CO2 | H2 | ||||
| Ⅰ | 恒温恒容 | 800 | 1.2 | 0.6 | 0 | 0 | 0.4 |
| Ⅱ | 恒温恒容 | 900 | 0.7 | 0.1 | 0.5 | 0.5 | |
| Ⅲ | 绝热恒容 | 800 | 0 | 0 | 1.2 | 0.8 | |
下列说法正确的是()
试题详情
下列说法正确的是( )
非选择题
试题详情
2—噻吩乙醇( )是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
)是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:

Ⅰ.制钠砂。向烧瓶中加入液体A和
金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至 , 加入
噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至 , 加入稍过量的环氧乙烷的四氢呋喃溶液,反应
。
Ⅳ.水解。恢复室温,加入水,搅拌
;加盐酸调
至4~6,继续反应
, 分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水 , 静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品
。
回答下列问题:
试题详情
“碳达峰·碳中和”是我国社会发展重大战略之一, 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:
Ⅰ:
Ⅱ:
请回答:
试题详情
硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是 的催化氧化:
的催化氧化:
 。研究表明,
。研究表明, 催化氧化的反应速率方程为
催化氧化的反应速率方程为 式中:k为反应速率常数,随温度t升高而增大;α为
式中:k为反应速率常数,随温度t升高而增大;α为 平衡转化率,α′为某时刻
平衡转化率,α′为某时刻 转化率,n为常数。在α′=0.90时,将一系列温度下的k、α值代入上述速率方程,得到的v-t曲线如图所示。下列说法正确的是( )
转化率,n为常数。在α′=0.90时,将一系列温度下的k、α值代入上述速率方程,得到的v-t曲线如图所示。下列说法正确的是( )

- A、 该反应在任何温度下都能自发
- B、
与足量
充分反应,放出的热量为
- C、 升高温度,能增大单位体积内活化分子百分数和活化分子数
- D、 反应速率先随温度的升高而增大,原因是温度升高导致k、α均增大
试题详情
羰基硫 是一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害,利于粮食的长期储存.在容积不变的密闭容器中,将
是一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害,利于粮食的长期储存.在容积不变的密闭容器中,将 和
和 混合后在催化剂和加热条件下达到下列平衡:
混合后在催化剂和加热条件下达到下列平衡: 。
。
试题详情
以废旧铜电路板为原料制备硫酸铜晶体可变废为宝,如图是某工厂的实际制备工艺流程。

资料1:流程中RH为有机化合物
试题详情
苯乙烯是合成橡胶和塑料的重要原料,可由乙苯为原料制得。
试题详情
空间站 还原转化系统能把呼出的
还原转化系统能把呼出的 捕集、分离并与空间站电解水系统产生的
捕集、分离并与空间站电解水系统产生的 进行加氢处理,从而实现空间站内物料的循环利用。
进行加氢处理,从而实现空间站内物料的循环利用。
试题详情
氢气作为一种清洁能源,一直是能源研究的热点,水煤气变换反应可用于大规模制 , 反应原理如下:
, 反应原理如下:

试题详情
(一)铁的常见化合价有+2、+3,在很强的氧化剂作用下也可形成不稳定的+6价高铁酸盐。实验室以FeCl2(aq)为原料制备高密度磁记录材料Fe/Fe3O4复合物,装置如图所示。在氩气气氛中,向装有50 mL 1 mol·L-1 FeCl2(aq)的三颈烧瓶中逐滴加入100 mL 14 mol·L-1 KOH(aq),100℃下搅拌回流3 h,得到成分为Fe和Fe3O4的黑色沉淀。待三颈烧瓶中的混合物冷却后,过滤,再依次用沸水和乙醇洗涤,40℃干燥后焙烧3 h,得到Fe/Fe3O4复合物产品 3.24 g。
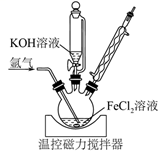
完成下列填空:
试题详情
烟气脱硫脱硝技术是环境科学研究的热点。某小组模拟O3氧化结合(NH4)2SO3溶液吸收法同时脱除SO2和NO的过程示意图如下。
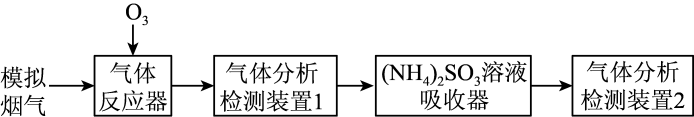
试题详情
某实验小组用下图装置制取氯气并进行实验探究。

完成下列填空:
试题详情
废旧锂电池的有效回收,可以减少环境污染,也能缓解贵金属资源危机。一种高效处理三元锂电池正极活性物质(其中金属元素的质量分数为 、
、 、
、 、
、 ),回收贵金属元素的工艺如下。
),回收贵金属元素的工艺如下。

已知:金属离子开始沉淀和完全沉淀的pH值如下表所示:
金属离子 | |||
开始沉淀的pH | 6.6 | 7.8 | 6.7 |
完全沉淀的pH | 9.2 | 10.4 | 9.5 |
回答下列问题:
试题详情
不锈钢具有良好的耐腐蚀性和耐磨性,铬(Cr)是不锈钢的重要成分。完成下列填空:


