选择题
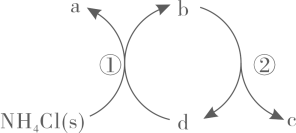
- A、
、
分别是
- B、
既可以是
, 也可以是
- C、 已知
为副产物,则通入水蒸气可减少
的产生
- D、 等压条件下,反应
、
的反应热之和,小于氯化铵直接分解的反应热
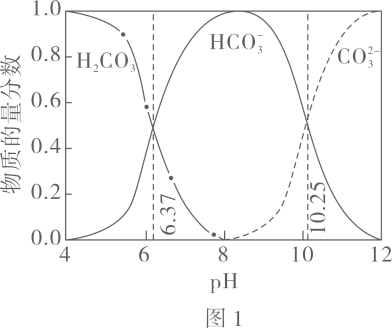
已知:图
中曲线表示
体系中各含碳粒子的物质的量分数与
的关系。
图
中曲线Ⅰ的离子浓度关系符合
;曲线Ⅱ的离子浓度关系符合
注:起始
, 不同
下
由图
得到
。
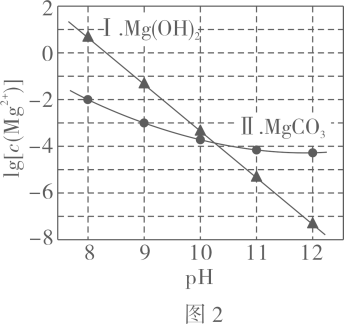
下列说法不正确的是( )
- A、 由图
,
- B、 由图
, 初始状态
, 无沉淀生成
- C、 由图
, 初始状态
, 平衡后溶液中存在
- D、 由图
和图
, 初始状态
、
, 发生反应:
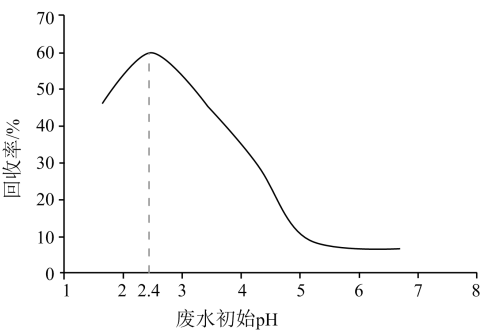
- A、 活性成分
在水中存在平衡:
- B、
的废水中
- C、 废水初始
, 随
下降,甲酸的电离被抑制,与
作用的
数目减少
- D、 废水初始
, 离子交换树脂活性成分主要以
形态存在
- A、 产生的气体中有H2
- B、 反应与
水解有关
- C、 Al(OH)3向酸式电离方向移动
- D、 M中含大量:Na+、Al3+、

下列说法正确的是
- A、 0.1 mol∙L-1 Na2SO3溶液中:
- B、 NaHSO3溶液中:
- C、 “沉淀”时发生主要反应的离子方程式:
- D、 “沉淀”分离后的滤液中:

常温下,的甘氨酸(
)溶液中各微粒浓度对数值与pH的关系如图所示:

下列说法正确的是( )
- A、 曲线③为
的浓度与pH的关系图
- B、
,
- C、
平衡常数的数量级为
- D、 C点溶液中满足:
| 试剂 | 现象 | |
| 1 | 酚酞 | 溶液变红,加水稀释,红色变浅 |
| 2 | 少量SO2 | 用pH试纸测得溶液pH≈8 |
| 3 | 少量Cl2 | 无明显现象 |
下列说法错误的是( )
- A、 Na2SO3(aq)中存在:c(OH-)=c(H+)+2c(H2SO3)+c(HSO3-)
- B、 实验1中随着水的不断加入,溶液中
的值逐渐增大
- C、 实验2反应后溶液中存在:c(Na+)>c(HSO3-)+2c(SO32-)
- D、 实验3反应后溶液中存在:c(H+)=c(Cl-)
- A、 丙醛能与
发生加成反应,丙酮也可以与
发生加成反应
- B、 乙烯中所有原子都在同一平面上,则2,3-二甲基-2-丁烯中所有碳也在同一平面上
- C、 往NaOH溶液通少量
, 生成
, 则往苯酚钠溶液中通入少量
, 也生成
- D、
溶液在空气中蒸干得到
固体,则
溶液在空气中蒸干也得到
固体

已知:
- A、
- B、
的
的值为
- C、 若将
完全转变为
, 仅需用酚酞做指示剂
- D、 图中c点,
- A、 在0.1 mol/L的Na2A溶液中,c(A2-)+c(HA-)+2c(Na+)=0.5 mol/L
- B、 25℃时,若测得0.1 mol/L的NaHA溶液pOH=a,升高温度,测得同浓度的NaHA溶液pOH=b,则b一定大于a
- C、 25℃时,将同浓度的NaHA和Na2A溶液等体积混合,其pH一定小于7
- D、 0.1 mol/L的NaHA溶液中离子浓度为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
多选题



 )溶液中含元素X物种的浓度之和为
)溶液中含元素X物种的浓度之和为 


实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
| ① |
| 饱和 | 产生白色沉淀 |
② |
| 光照管壁有气泡产生 | ||
③ |
| 溶液变红 | ||
④ |
| 产生白色沉淀 |
以下判断错误的是( )


非选择题
具体步骤如下:
Ⅰ.称取 , 用
水溶解。
Ⅱ.分批加入后,将溶液温度降至
以下,加入
活性炭、
浓氨水,搅拌下逐滴加入
的双氧水。
Ⅲ.加热至反应
。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
I.验证和
对Mg与水反应的促进作用
实验序号 | a | b | c | d |
0.1 mol·L | NaCl | |||
30 min内产生气体的体积/mL | 1.5 | 0.7 | <0.1 | 1.4 |
气体的主要成分 | ||||
30 min时镁条表面情况 | 大量固体附着(固体可溶于盐酸) | |||
I.铜盐的溶解:准确称取硫酸铜样品0.5g于碘量瓶中,加入1mol/L溶液和30mL
使之溶解。
II.滴定:向上述碘量瓶中加入5mL20%KI溶液,立即用0.1mol/L标准溶液滴定至浅黄色。然后加入1mL淀粉溶液,继续滴定溶液呈浅蓝色。再加入5mL10%KSCN溶液,摇匀后溶液蓝色转深,再继续滴定到终点,消耗
标准溶液的体积为
。回答下列问题:
完成下列填空:
 已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
② 对浸出渣的处理,直至得到产品,都在封闭的管道内进行。
③ pH>3,则 BiCl3极易水解生成不溶性的 BiOCl 沉淀。
请回答以下问题:
a.查阅资料:①常温下0.1mol•L-1的H2SO3溶液的pH约为2.1。②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸。常温下0.1mol•L-1的H2S溶液的pH约为4.5。
b.实验操作:
①准确称取纯净的Na2SO3•7H2O晶体31.500g,配成1L水溶液,测得其pH=7.8。
②再次准确称取31.500g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重 (只有硫元素的化合价变化成最高价和最低价),质量为15.750g。
③将②所得的15.750g固体进行元素定性定量分析,组成与Na2SO3无异。将其溶于水得250.00mL溶液,测得pH=10.3。
c.分析猜想:Na2SO3•7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
d.交流讨论

已知:①Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2
②Na2SO4溶解度如图2所示。

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Co2+ | 7.6 | 9.4 |
| Al3+ | 3.0 | 5.0 |
| Zn2+ | 5.4 | 8.0 |

碳酸锂的溶解度(g/L)如表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
回答下列问题:


