选择题
试题详情
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y同周期并相邻,Y是组成水的元素之一,Z在同周期主族元素中金属性最强,W原子在同周期主族元素中原子半径最小,下列判断正确的是( )
- A、
是非极性分子
- B、 简单氢化物沸点:
- C、 Y与Z形成的化合物是离子化合物
- D、 X、Y、Z三种元素组成的化合物水溶液呈酸性
试题详情
科学家合成了一种新的共价化合物(结构如图所示),X、Y、Z、W为原子序数依次增大的短周期元素,W的原子序数等于X与Y的原子序数之和。下列说法错误的是( )
- A、 原子半径:
- B、 非金属性:
- C、 Z的单质具有较强的还原性
- D、 原子序数为82的元素与W位于同一主族
试题详情
下列推测不合理的是( )
- A、 相同条件下,Br2与PBr3反应比Cl2与PCl3反应难
- B、 OPBrCl2与足量H2O作用生成2种酸
- C、 相同条件下,与水反应由快到慢的顺序:OPBr3、OPCl3、OPF3
- D、 PBr3与足量C2H5OH作用可得到P(OC2H5)3
试题详情
R、X、Y、Z、M五种短周期主族元素,原子序数依次增大。基态R原子每个能级上电子数相等,基态X原子的价层电子排布为 , Y与M同主族,Z是同周期元素中原子半径最大的元素,Z核电荷数等于X、M原子的最外层电子数之和。下列说法不正确的是
, Y与M同主族,Z是同周期元素中原子半径最大的元素,Z核电荷数等于X、M原子的最外层电子数之和。下列说法不正确的是
- A、 电负性:Y>X>R
- B、 原子半径:Z>M>Y
- C、 氢化物的沸点:R<Y
- D、 Z与Y可形成两种常见的离子化合物,且晶体中的阴阳离子个数比均为1∶2
试题详情
X、Y、Z、Q、T五种元素,原子序数依次增大。X原子 轨道上有1个空轨道,Y原子的
轨道上有1个空轨道,Y原子的 轨道只有一对成对电子,Z原子M层上有两个未成对电子,Q最高价氧化物对应水化物是常见的三元酸,微粒
轨道只有一对成对电子,Z原子M层上有两个未成对电子,Q最高价氧化物对应水化物是常见的三元酸,微粒 的价电子构型是
的价电子构型是 。下列说法不正确的是
。下列说法不正确的是
- A、 第一电离能:
- B、 X和Q各有一种单质的结构单元是正四面体
- C、 Y和Z形成的化合物为分子晶体
- D、 T与Y可形成阴离子
试题详情
氧元素的非金属性比氯元素的非金属性强,下列说法中,能支持该结论的是( )
- A、 相同条件下,氯气与铁反应生成氯化铁,氧气与铁反应生成四氧化三铁
- B、 氧元素与氯元素形成的化合物中,氧元素显负化合价,氯元素显正化合价
- C、 氧原子最外层电子数比氯原子最外层电子数少
- D、 氧原子的半径比氯原子的半径小
试题详情
由主族元素X、Y、Z、W组成的化合物ZX4W(YX4)3具有良好的储氢性能,其中,X、Y、Z是短周期元素,  与
与 均为10电子数微粒,四种元素的原子序数之和为33。下列有关说法错误的是
均为10电子数微粒,四种元素的原子序数之和为33。下列有关说法错误的是
- A、 X与Y、Z均可形成多种化合物
- B、 非金属性:Z> Y> >X
- C、 X、W元素可形成离子化合物
- D、 原子半径:W> Y> Z> >X
试题详情
短周期主族元素X、Y、Z、W原子序数依次增大,其中X、Y、Z可形成的化合物是一种具有发展前景的“绿色”化工产品( 如图所示),W是短周期中金属性最强的元素,下列说法正确的是

- A、 简单氢化物的稳定性: Y<Z
- B、 原子半径: X<Y<Z<W
- C、 X2Z2、W2Z2中所含化学键类型完全相同
- D、 W的最高价氧化物的水化物是一种弱碱
试题详情
X、Y、Z、W为原子序数依次增大的前四周期元素,X与Y能形成多种常见二元化合物,Y与Z形成的某化合物是参与光合作用的主要气体,基态原子中X,Y、Z的价电子数之和等于W的价电子数。下列说法正确的是
- A、 W属于d区元素
- B、 原子半径:X<Y<Z
- C、 氢化物沸点:Y<Z
- D、 基态原子的最外层电子数:X=W
试题详情
短周期元素X、Y、Z在周期表中的位置如图所示,下列说法中错误的是
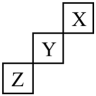
- A、 X元素的最外层电子数为2
- B、 X、Y、Z的单质中X最稳定
- C、 气态氢化物的稳定性:Y<Z
- D、 Z的最高价氧化物的化学式为ZO3
试题详情
R、X、Y、Z均为短周期元素,R与X同族,X的原子半径在这四种元素中是最小的, 和
和 均达到了8电子稳定结构,R的原子序数大于Z,Y原子的最外层电子数为Z原子与X原子的最外层电子数之差。下列叙述正确的是
均达到了8电子稳定结构,R的原子序数大于Z,Y原子的最外层电子数为Z原子与X原子的最外层电子数之差。下列叙述正确的是
- A、 R的氯化物水溶液呈酸性
- B、 X的单质还原性比R的单质强
- C、 Y位于第三周期第VIA族
- D、 Z的原子半径比Y小
试题详情
用α粒子( )分别轰击
)分别轰击 和
和 , 发生核反应:
, 发生核反应: 和
和 , 其中基态
, 其中基态 原子的能级数与未成对电子数相等。下列说法正确的是
原子的能级数与未成对电子数相等。下列说法正确的是
- A、 与X同周期的元素中,第一电离能比X小的元素有两种
- B、 X和Z在其最高价氧化物的水化物中均采用
杂化
- C、
的键角大于
的键角
- D、 X、Y、Z的单质均为分子晶体
试题详情
X、Y、Z、M是电负性逐渐减小的短周期非金属元素。X、Z、M位于三个不同周期,Y与Z的价电子数之和为M价电子数的两倍;化合物 的电子总数为18个。下列说法错误的是
的电子总数为18个。下列说法错误的是
- A、 Y的含氧酸为弱酸
- B、 Z与M形成的化合物具有较强的还原性
- C、 简单氢化物的稳定性:X>Y>M
- D、 原子半径:Z<X<Y<M
试题详情
X、Y、Z、Q、W是原子序数依次增大的前四周期元素,X、Z的基态原子2p能级上各有两个未成对电子,Y与Q同主族,W原子N能层只有一个电子,其余能层全充满。下列说法错误的是

- A、 电负性为Z>Y>X
- B、 原子半径为r(Q)>r(Y)>r(Z)
- C、 X与Z可以形成含极性键的非极性分子
- D、 W与Z形成的化合物晶胞如图,其化学式为WZ
试题详情
W、X、Y、Z为原子序数依次增大的短周期元素,原子序数之和为32;M是由这四种元素组成的化合物,其化学式为YZX2W2(其中每种元素只有一种化合价);将8.0gM投入水中有刺激性气味的气体放出,该气体能使湿润的红色石蕊试纸变蓝,向所得溶液中通入足量的CO2 , 经过滤等一系列操作后得到7.8g的白色固体。下列叙述错误的是
- A、 四种元素中有两种金属元素
- B、 原子半径:Y>Z>X
- C、 M与盐酸反应能生成三种离子化合物
- D、 Y元素最高价氧化物的水化物能溶解Z元素最高价氧化物
试题详情
某种天然硅酸盐矿石主要成分的化学式为R[Z2W3Y10]•3X2Y,其中X、Y、Z、W、R是主族元素,原子序数依次增大,且处于四个不同周期。Y元素是地壳中含量最高的元素,化合物RY在实验室中常用作干燥剂。下列说法正确的是
- A、 原子半径:W>Z>Y
- B、 工业制备Z单质采用热还原法
- C、 X和R形成的化合物,X显负价
- D、 W的最高价氧化物可溶于稀硝酸
试题详情
有a、b、c、d四种短周期主族元素,它们在周期表中的位置如图所示,已知四种元素中只有b为金属元素,则下列有关说法中正确的是( )
|
|
| a |
|
| b | c | d |
- A、 第一电离能:d>c>b
- B、 离子半径:c>d>a
- C、 简单气态氢化物的稳定性:a<c<d
- D、 c的最高价氧化物的水化物为强酸
试题详情
短周期主族元素X、Y、Z、W原子序数依次增大,Y比X原子的核外电子数多1个,X与Z原子最外层电子数之比为 。下列说法错误的是( )
。下列说法错误的是( )
- A、 X、Y一定位于同一周期,Y、Z可能不位于同一周期
- B、 X气态氢化物分子的空间构型一定是正四面体
- C、 Y最高价氧化物对应的水化物可能是强电解质
- D、 若Y、Z、W位于同一周期,则电负性:
试题详情
有机金属氯化物由原子序数依次增大的短周期主族元素X、Y、Z、M、N组成,部分结构如图所示,基态原子M核外电子所占据原子轨道全充满,N元素的价层电子排布式为nsn-1np2n-1。下列说法错误的是( )
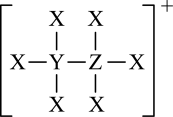
- A、 YN4为正四面体结构
- B、 氢化物的沸点Z>Y
- C、 Z元素的第一电离能比同周期相邻元素的大
- D、 与M同族元素的基态原子最高能级的电子云轮廓图呈球形
试题详情
X、Y、Z、W是前4周期原子序数依次增大的主族元素,X在周期表中非金属性最强,Y的周期序数与族序数相等,Z原子次外层电子数是核外电子总数的一半,基态W原子核外16个轨道上填有电子。下列说法正确的是( )
- A、 原子半径:r(X) <r(Y) <r(Z) <r(W)
- B、 Z的简单气态氢化物沸点比X的高
- C、 第一电离能:I1(W) <I1(Y) <I1(Z)
- D、 W最高价氧化物对应的水化物为可溶性强碱
试题详情
X、Y、Z和W为原子序数依次增大的短周期主族元素, X、Z同主族且能形成离子化合物,YW同主族且原子序数之和为24。四种元素组成的一种化合物 M具有下列性质: 白色沉淀 M
M 溶液褪色并产生气泡。下列说法正确的是( )
溶液褪色并产生气泡。下列说法正确的是( )
- A、 原子半径: W>Z>Y>X .
- B、 简单氢化物的稳定性: W>Y
- C、 Y与X、Z、W均能形成具有漂白性的物质
- D、 X、Z形成的离子化合物中阴阳离子核外电子排布相同
多选题
试题详情
某种化合物的结构式如图所示,其中W、X、Y、Z为原子序数依次增大的短周期元素,只有X、Y在同一周期,Z的单质是黄绿色气体。下列有关说法错误的是( )

非选择题
试题详情
1962年首个稀有气体化合物XePtF6问世,目前已知的稀有气体化合物中,含氙(54Xe)的最多,氪(36Kr)次之,氩(18Ar)化合物极少。[BrOF2][AsF6]•xKrF2是[BrOF2]+、[AsF6]-与KrF2分子形成的加合物,回答下列问题:
试题详情
卤族元素能形成多种物质,结构和性质之间充满联系。
试题详情
新工艺采用金属氧化物 催化尿素与甲醇合成碳酸二甲酯
催化尿素与甲醇合成碳酸二甲酯 , 副产物氨气回收重新生成尿素,有关的方程式如下:
, 副产物氨气回收重新生成尿素,有关的方程式如下:
反应①: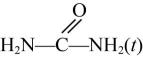 +2CH3OH(g)
+2CH3OH(g)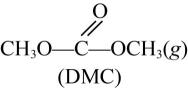 +2NH3(g)
+2NH3(g)
反应②:2NH3(g)+CO2(g) +H2O(l)
+H2O(l)
完成下列填空:
试题详情
我国嫦娥五号探测器带回1.731kg的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素A、B、C、D,原子序数依次增大,最外层电子数之和为15。B、C、D为同周期相邻元素,A为地壳中含量最多的元素。回答下列问题:
试题详情
氢是宇宙中最丰富的元素,H2有多种制法。完成下列填空:
试题详情
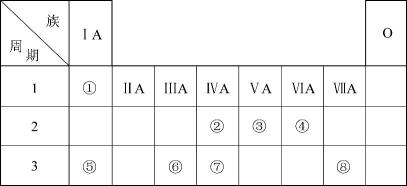
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
试题详情
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子2p轨道上有3个电子,Z是元素周期表中电负性最大的元素,W与Y同主族。下列说法正确的是( )
- A、 原子半径:r(W)>r(Z)>r(Y)>r(X)
- B、 X氧化物的水化物是一定是强酸
- C、 Y的第一电离能比同周期相邻元素小
- D、 W的简单气态氢化物的稳定性比Y的强
试题详情
光电材料在能源军事等领域有重要应用,分为无机光电材料如ZnS、ZnSe、GaAs、 等,及有机光电材料(如图1所示化合物)。回答下列问题:
等,及有机光电材料(如图1所示化合物)。回答下列问题:
试题详情
镍铜合金是由60%镍、33%铜、6.5%铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能,耐腐蚀性好,耐磨性好,容易加工,无磁性,是制造电子管较好的结构材料。请回答下列问题:
试题详情
新型半导体材料GaN、SiC主要应用于功率半导体、射频和光电器件领域。



