选择题
试题详情
下图为 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(
关系图( ;
; 可认为
可认为 离子沉淀完全)。下列叙述正确的是
离子沉淀完全)。下列叙述正确的是

- A、 由
点可求得
- B、
时
的溶解度为
- C、 浓度均为
的
和
可通过分步沉淀进行分离
- D、
混合溶液中
时二者不会同时沉淀
试题详情
碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:
[已知
,
,
的电离常数
],下列有关说法正确的是
- A、 上层清液中存在
- B、 上层清液中含碳微粒最主要以
形式存在
- C、 向体系中通入
气体,溶液中
保持不变
- D、 通过加
溶液可实现
向
的有效转化
试题详情
锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有 和
和 杂质离子,可在0~14范围内调节
杂质离子,可在0~14范围内调节 对其净化(即相关离子浓度
对其净化(即相关离子浓度 )。
)。 时,
时, 与
与 关系见下图(碱性过强时
关系见下图(碱性过强时 和
和 会部分溶解)。下列说法正确的是( )
会部分溶解)。下列说法正确的是( )
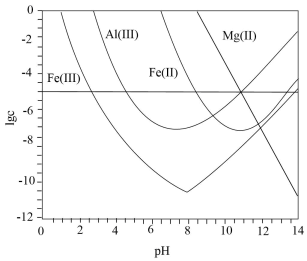
- A、
可被净化的
区间最大
- B、 加入适量
, 可进一步提升净化程度
- C、 净化的先后顺序:
- D、
试题详情
四水合磷酸锌[ , 难溶于水]是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含
, 难溶于水]是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含 、
、 、
、 、
、 、
、 、
、 、
、 等)为原料制备
等)为原料制备 的流程如下:
的流程如下:

下列说法错误的是
- A、 滤渣Ⅰ的主要成分是
、
- B、 “除铁”中,用试剂x凋节溶液的pH约5.1后加
的目的是将
氧化为
- C、 若试剂y选择ZnS将溶液中
转化为CuS除去,说明
- D、 沉锌后的母液可回收利用的物质有
、
试题详情
工业上用氨水作为沉淀剂去除酸性废水中的铅元素。除铅时,体系中含铅微粒的物质的量分数(d)与pH的关系如图所示[已知:常温下, ;
; 难溶于水]。下列说法错误的是
难溶于水]。下列说法错误的是

- A、
时,
与氨水反应生成
, 溶液中
- B、
时,
- C、
时,
物质的量分数最大,除铅效果最好
- D、
时,
转化为
的离子方程式为
试题详情
已知25℃时, 的平衡常数
的平衡常数 ,
,  , 下列叙述中正确的是
, 下列叙述中正确的是
- A、 向
的混合液中滴加
溶液,首先析出
沉淀
- B、 将浓度均为
的
、
溶液等体积混合后可得到
沉淀
- C、 25℃时,
的
约为
- D、 相同温度下,
在水中的
大于在
溶液中的
试题详情
常温下,向25 mL0.12 mol/L AgNO3溶液中逐滴加入浓度为2%的氨水,先出现沉淀,继续滴加沉淀溶解。该过程中加入氨水的体积V与溶液中lg 的关系如图所示。已知e点时溶液迅速由浑浊变得澄清,且此时溶液中c(Ag+)与c(NH3)均约为2×10-3 mol/L。下列叙述错误的是( )
的关系如图所示。已知e点时溶液迅速由浑浊变得澄清,且此时溶液中c(Ag+)与c(NH3)均约为2×10-3 mol/L。下列叙述错误的是( )

- A、 a点溶液呈酸性的原因是AgNO3水解
- B、 b点溶液中:c(Ag+)+c[Ag(NH3)2+]<c(NO3-)
- C、 由e点可知,反应Ag++2NH3
 [Ag(NH3)2]+平衡常数的数量级为105
[Ag(NH3)2]+平衡常数的数量级为105 - D、 c~d段加入的氨水主要用于沉淀的生成和溶解
试题详情
难溶物在水溶液中存在沉淀溶解平衡,已知Ksp(CaSO4)=9.0×10-6 , Ksp(CaCO3)=2.8×10-9 , 离子浓度与物质常温下的溶解度关系如图所示,下列说法正确的是

- A、 L1为CaSO4曲线,L2为CaCO3曲线
- B、 c1的数量级为10-4 , c2=3.0×10-3mol/L
- C、 常温下L1溶解度:a>d,a>e
- D、 降低温度a点可移动至c点
试题详情
室温下,用0.100 的标准AgNO3溶液滴定20.00mL浓度相等的NaCl、NaBr和NaI的混合溶液,通过电位滴定法获得lgc(Ag+)与V(AgNO3)的关系曲线如图所示(忽略沉淀对离子的吸附作用。若溶液中离子浓度小于
的标准AgNO3溶液滴定20.00mL浓度相等的NaCl、NaBr和NaI的混合溶液,通过电位滴定法获得lgc(Ag+)与V(AgNO3)的关系曲线如图所示(忽略沉淀对离子的吸附作用。若溶液中离子浓度小于
 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。 ,
,  ,
,  )。下列说法错误的是
)。下列说法错误的是

- A、 a点溶液中有黄色沉淀生成
- B、 原溶液中NaCl、NaBr和NaI的浓度为0.0500mol·L−1
- C、 当Br−沉淀完全时,已经有部分Cl−沉淀,故第二个突跃不明显
- D、 b点溶液中:
试题详情
ROH是一元弱碱,难溶盐RA、RB的两饱和溶液中c(A-)或c(B- )随c(OH-)而变化,A-、B-不发生水解。实验发现,298 K时c2(A- )与c(OH- )或c2(B- )与c(OH- )的关系如图所示,甲表示c2(A- )与c(OH- )关系。下列叙述错误的是( )

- A、 RA饱和溶液在pH=6时,c(A- )≈1.73 ×10-5mol·L-1
- B、 RB的溶度积Ksp(RB)的数值为5×10-11
- C、 ROH的电离平衡常数Kb(ROH)的数值为2×10-6
- D、 当RB的饱和溶液pH=7时,c(R+ )+c(H+ )<c(B- )+c(OH-)
试题详情
T℃下,三种硫酸盐MSO4 , (M表示Pb2+或Ba2+或Sr2+)的沉淀溶解平衡曲线如图所示。已知pM=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )

- A、 BaSO4在任何条件下都不可能转化成PbSO4
- B、 X点和Z点分别是SrSO4和BaSO4的饱和溶液,对应的溶液中c(M)=c(SO42-)
- C、 在ToC时,用0.01mol.L-1Na2SO4溶液滴定20mL浓度均是0.01mol.L-1的Ba(NO3)2和Sr(NO3)2的混合溶液,Sr2+先沉淀
- D、 ToC下,反应PbSO4(s)+Ba2+(aq)
 BaSO4(s)+Pb2+(aq)的平衡常数为102.4
BaSO4(s)+Pb2+(aq)的平衡常数为102.4
试题详情
取1.0L浓缩卤水( 、
、 浓度均为
浓度均为 )进行实验:滴加一定量
)进行实验:滴加一定量 溶液,产生黄色沉淀;继续滴加,产生白色沉淀。已知:
溶液,产生黄色沉淀;继续滴加,产生白色沉淀。已知: 、
、 。下列分析错误的是( )
。下列分析错误的是( )
- A、 黄色沉淀是
, 白色沉淀是
- B、 产生白色沉淀时,溶液中存在
- C、 若起始时向卤水中滴加2滴(0.1
)
, 能产生沉淀
- D、 白色沉淀开始析出时,
试题详情
常温下,向10 mL一定浓度的硝酸银溶液中,逐滴加入0.1 mol·L-1的氨水,反应过程中- 1gc(Ag+ )或-1gc([(Ag(NH3)2]+ )与加入氨水体积的关系如图所示。下列说法错误的是( )
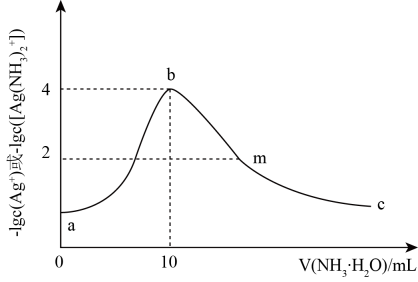
- A、 常温下,Kpsp(AgOH)的数量级为10-8
- B、 原硝酸银溶液的浓度是0.1 mol·L-1
- C、 溶液m点c(
)-c(Ag+)-c(
)=0.01 mol·L-1
- D、 溶液b点
的浓度大于溶液m点的
浓度
多选题
试题详情
已知CaF2是难溶于水、可溶于酸的盐。常温下,用盐酸调节CaF2浊液的pH,测得在不同pH条件下,体系中 与-lgc(X)(X为Ca2+或F- )的关系如图所示。
与-lgc(X)(X为Ca2+或F- )的关系如图所示。

下列说法错误的是( )
试题详情
向某  和
和  的混合溶液中逐滴加入某浓度的
的混合溶液中逐滴加入某浓度的  溶液,测得溶液中离子浓度的关系如图所示,下列说法正确的是( )
溶液,测得溶液中离子浓度的关系如图所示,下列说法正确的是( )
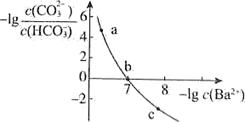
试题详情
25 ℃ 时,AgCl的Ksp=1.8×10-10 , Ag2CO3在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )

试题详情
向氯化铁溶液中加入过量氢氧化钠溶液 震荡后静置一段时间.下列关于该体系的说法中,不正确的是( )
试题详情
下列有关说法正确的是()
试题详情
高铁酸钾  是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:

下列叙述错误的是( )
试题详情
根据下列实验操作和现象所得出的结论一定正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 将燃着的镁条迅速伸入集满CO2的集气瓶,剧烈反应,发光发热,瓶内产生大量白烟,瓶壁上有黑色颗粒 | CO2在一定条件下能支持燃烧 |
| B | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
| D | 将少量铁粉、5mL苯和1mL液溴混合后产生的气体通入AgNO3溶液中,产生淡黄色沉淀 | 苯和液溴发生了取代反应 |
试题详情
常温下,向25 mL0.12 mol/LAgNO3溶液中逐滴加入一定浓度的氨水,先出现沉淀,继续滴加沉淀溶解。该过程中加大氨水的体积V与溶液中lg[c(H+ )/c(OH- )]的关系如图所示。已知e点对应的溶液迅速由浑浊变得澄清,且此时溶液中c(Ag+)与c(NH3)均约为2×10-3 mol/L。下列叙述错误的是( )
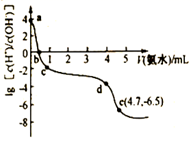
试题详情
已知一定温度下CuS的溶度积常数为4.0×10-36 , 现将0.1molCuSO4放入100mL1.0mol·L-1的Na2S溶液中,充分搅拌反应(不考虑溶液体积变化),则下列说法错误的是( )
试题详情
下列有关说法中正确的是( )
非选择题
试题详情  是一种压电材料。以
是一种压电材料。以 为原料,采用下列路线可制备粉状
为原料,采用下列路线可制备粉状 。
。
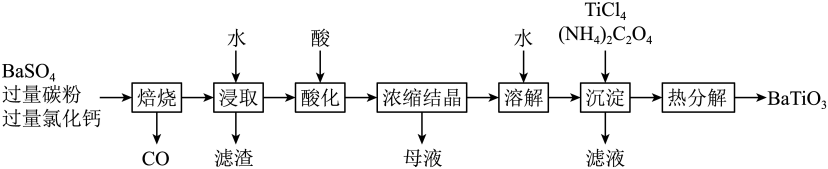
回答下列问题:
试题详情
自发热材料在生活中的应用日益广泛。某实验小组为探究“ ”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(
”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值( )随时间(t)的变化曲线,如图所示。
)随时间(t)的变化曲线,如图所示。
| 实验编号 | 反应物组成 |
| a |
|
| b |
|
| c |
|
| d |
|
| e |
|
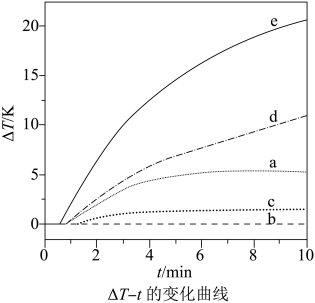
回答下列问题:
试题详情
钪(Sc)是一种稀土金属,钪及其化合物在宇航、电子、超导等方面有着广泛的用途。钛白粉中含有 等多种成分,用酸化后的钛白废水富集钪,并回收氧化钪(Sc2O3)的工艺流程如下:
等多种成分,用酸化后的钛白废水富集钪,并回收氧化钪(Sc2O3)的工艺流程如下:

回答下列问题:
试题详情
以软锰矿(主要成分为MnO2 , 还含少量Fe、Si、Al、Ca、Mg等的氧化物)和硫铁矿(主要成分FeS2)为原料,两矿联合浸取可制备大颗粒的电池用Mn3O4。

试题详情
K2Cr2O7是化学实验室中的一种重要分析试剂。工业上以铬铁矿[Fe(CrO2) 2 , 含Al、Si氧化物等杂质]为主要原料制备K2Cr2O7的工艺流程如图所示。
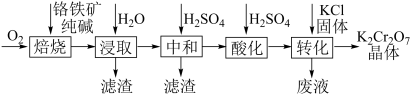
试题详情
高铁酸钾(K2FeO4)是一种多功能的新型水处理剂。一种湿法制备高铁酸钾的新工艺流程如图所示:

已知:①高铁酸钾热稳定性差
②在碱性环境中比酸性环境中相对稳定。
回答以下问题:
试题详情
碘化亚铜( )可用作有机反应催化剂。某化学兴趣小组以黄铜矿(主要成分为
)可用作有机反应催化剂。某化学兴趣小组以黄铜矿(主要成分为 , 其中
, 其中 的化合价为+2)为原料制备
的化合价为+2)为原料制备 的流程如下:
的流程如下:

已知:是白色粉末,不溶于水,能与过量
继续反应:
, 从而溶于
溶液中。
回答下列问题:
试题详情
五氧化二钒常用于生产硫酸或石油精炼的催化剂。某化工厂从废钒催化剂中(含有 等)回收
等)回收 和
和 , 既能避免环境污染,又能节约资源。回收工艺流程如下:
, 既能避免环境污染,又能节约资源。回收工艺流程如下:

已知:1:①"酸浸”时,和
先与稀硫酸反应分别生成
和
;
②有机萃取剂萃取的能力比萃取
的能力强;
③微溶于冷水、易溶于热水、难溶于乙醇;
④溶液中与
可相互转化:
。
回答下列问题:
试题详情
磷矿是重要的化工矿物原料,贵州磷矿储量丰富。磷酸二氢钙[Ca(H2PO4)2]是一种磷肥。某工厂利用磷矿(含Ca、P、Fe、Mg、Si 等元素)进行综合生产的部分流程如下:
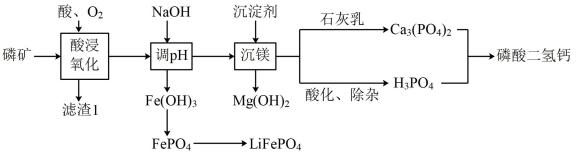
已知: Ksp[Fe(OH)3]=1×10-38 , Ksp[Mg(OH)2]= 1 ×10-11。
回答下列问题:
试题详情
As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水[砷主要以亚砷酸(H3AsO3)形式存在]通过如下流程转化为粗As2O3。
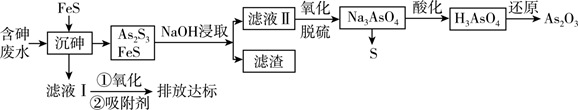
已知:Ⅰ. As2S3+ 6NaOH = Na3AsO3 + Na3AsS3+ 3H2O
Ⅱ. As2S3(s) + 3S2-(aq) 2
(aq)
Ⅲ.砷酸(H3AsO4)在酸性条件下有强氧化性,能被SO2、氢碘酸等还原。
试题详情
由难溶性磷酸锂渣(主要成分为Li3PO4)为原料制备电池级Li2CO3的流程如下:
![]()
已知:①Li2CO3在不同温度下的溶解度: 0℃ 1.54g,20℃ 1.33g, 90℃ 0.78g。
②碳酸锂:水溶液煮沸时容易发生水解。
试题详情
三元锂电池的正极材料中可含有大量的金属锂元素(Mn x Ni y O 1-y Mn x Ni y O 2),还含有铝、铝和有机等。、镍、钴材料、锰等的流程如下所示。



