选择题
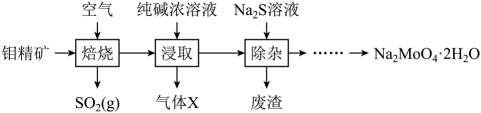
已知:浸取液溶质主要为和
。
- A、 焙烧时发生反应
- B、 气体X为
, 废渣的主要成分为
- C、 从滤液中获得
的操作为蒸发结晶
- D、 利用纯碱吸收
, 可获得副产品亚硫酸钠

- A、 可用
溶液代替步骤①中的
溶液
- B、 步骤②发生反应的离子方程式为:
- C、 步骤③包含过滤洗涤等操作
- D、 溶液1和溶液2的主要成分相同,但浓度不同

已知:镉(Cd)的金属活动性介于锌、铁之间。下列说法错误的是( )
- A、 “浸取”步骤所用的1L0.1mol/L的硫酸中,氧原子的数目大于0.4NA
- B、 “氧化”步骤的目的是将Fe2+氧化为Fe3+ , 同时将Mn2+氧化为MnO2除去
- C、 “氧化”步骤加入氧化镉的目的是调pH,除去杂质元素
- D、 “电解”步骤中,阴极生成11.2g金属镉时,阳极生成气体的体积为1.12L

下列说法正确的是( )
- A、 焙烧后的废气能使酸性高锰酸钾溶液褪色
- B、 通氯气主要目的是提高CuCl2▪2H2O晶体的产率
- C、 调节pH选用的试剂可以是NaOH溶液
- D、 CuCl2▪2H2O晶体直接加热可制得CuCl2固体
| 选项 | 物质 | 除杂试剂 | 分离方法 |
| A | 二氧化硅(碳酸钙) | 氢氧化钠溶液 | 过滤 |
| B | 硫酸铜溶液(硫酸铁) | 加入过量铜粉 | 过滤 |
| C | 乙醇(乙酸) | 生石灰 | 蒸馏 |
| D | SO2(CO2) | 碳酸钠溶液 | 洗气 |
- A、 A
- B、 B
- C、 C
- D、 D

下列说法正确的是( )
- A、 固体1中主要含有CaCO3、CaSO3
- B、 X可以是空气,且需过量
- C、 捕获剂所捕获的气体主要是CO
- D、 处理含
废水时,发生的反应为:
+5
+4H+=6NO↑+4H2O

下列说法正确的是( )
- A、 为了加快反应速率,步骤②所需要的温度越高越好
- B、 工业上经常使用碳酸氢钠溶液来清除废铁屑表面的油污
- C、 铁屑中含有少量硫化物,反应产生的气体需要净化处理,所以应将尾气直接通入到盛有足量水的烧杯中吸收
- D、 步骤⑤中的具体实验操作有加热浓缩、冷却结晶、过滤(洗涤),经干燥得到硫酸铁铵晶体样品

- A、 用装置甲灼烧碎海带
- B、 用装置乙过滤海带灰的浸泡液
- C、 用装置丙制备Cl2 , 用于氧化浸泡液中I-
- D、 用装置丁吸收尾气中的Cl2
非选择题
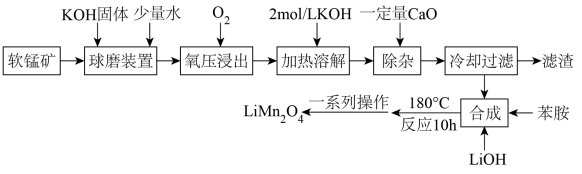
已知:
①软锰矿的成分如下:
| 成分 | MnO2 | Fe2O3 | CaO | SiO2 | 其他不反应杂质 |
| 质量分数 | 69.6% | 7.6% | 5.6% | 9.0% | 8.2% |
②K2MnO4在强碱性溶液(pH大于13.5)中稳定,在酸性、中性和弱碱性环境中会发生歧化反应生成和MnO2。
③苯胺(C6H5NH2)还原性较强,在该条件下可被氧化为硝基苯(C6H5NO2)。
④锰酸锂为灰黑色粉末,离子化合物,易溶于水,难溶于无水乙醇。

已知:①单宁酸是一种只含C、H、O元素的有机化合物
② , 常温下
,
,
,
③当溶液中某离子的物质的量浓度不大于时,该离子沉淀完全

已知几种金属阳离子的氢氧化物沉淀时的pH如下表:
金属阳离子 | ||||
开始沉淀时pH | 1.5 | 3.3 | 6.5 | 5.2 |
沉淀完全时pH | 3.7 | 5.0 | 9.7 | — |
![]()
已知:①含锌组分间的转化关系:Zn2+Zn(OH)2
②ε−Zn(OH)2是Zn(OH)2的一种晶型,39℃ 以下稳定。
请回答:
 已知:①
已知:① 微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的
离子生成
而溶解。②浸出液A含有大量
及少量
金属离子。

已知:①有关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀的pH | 9.0 | 3.7 | 6.7 | 9.8 |
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③Ksp[Fe(OH)3]=4.0×10-8。
回答下列问题:

有关物质的性质如下表所示:
| 甘氨酸(H2NCH2COOH) | 易溶于水,能溶于冰醋酸,难溶于乙醇、乙醚,水溶液呈弱酸性。 |
| 柠檬酸 | 易溶于水和乙醇,酸性较强,有强还原性。 |
| 甘氨酸亚铁 | 易溶于水且在水中难电离,难溶于乙醇、冰醋酸。 |
实验步骤如下:
Ⅰ.打开K1、K3 , 向c中通入气体,待确定c中空气被排尽后,将b中溶液加入到c中。
Ⅱ.在50℃恒温条件下用磁力搅拌器不断搅拌,然后向c中滴加适量NaOH溶液调溶液pH至5.5左右,使反应物充分反应。
Ⅲ.反应完成后,向c中加入无水乙醇,析出沉淀,过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
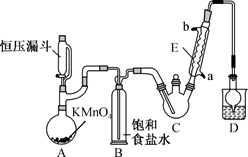
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸)
③相关物质的相对分子质量及部分物理性质:
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| C2H5OH | 46 | ﹣114.1 | 78.3 | 与水互溶 |
| CCl3CHO | 147.5 | ﹣57.5 | 97.8 | 可溶于水、乙醇 |
| CCl3COOH | 163.5 | 58 | 198 | 可溶于水、乙醇、三氯乙醛 |
| C2H5Cl | 64.5 | ﹣138.7 | 12.3 | 微溶于水,可溶于乙醇 |
 +CH3COOH
+CH3COOH
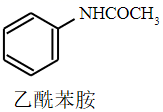 +H2O
+H2O
乙酸、苯胺、乙酰苯胺的部分物理性质如下表
| 乙酸 | 苯胺 | 乙酰苯胺 | |
| 沸点 | 118 | 184 | 304 |
| 状态 | 无色液体 | 无色液体 | 白色固体 |
| 在水中的溶解度 | 易溶于水 | 易溶于水20℃溶解度3.6g | 20℃溶解度0.46g;80℃溶解度3.5g;100C溶解度18g |
实验过程:①在50mL蒸馏瓶中加入沸石、乙酸7.4mL(过量),苯胺5mL,实验装置如下图所示(加热装置略去),先小火加热10分钟,再控制分馏柱温度为105℃,加热至反应完成。

②趁热将反应后的混合物倒入装有100mL冷水的烧杯中,快速搅拌,用布氏漏斗抽滤。
③洗涤沉淀、再抽滤得固体,检验乙酰苯胺中的乙酸是否被除尽。
④将沉淀转移到表面皿上,加热蒸发,除去水。
回答下列问题:

相关物质的数据及性质如下表:
| 主要性状 | 熔点/℃ | 沸点/℃ | 主要化学性质 | |
| SOCl2 | 淡黄至红色发烟液体 | -105 | 78.8 | 遇水分解, 140℃开始分解 |
| S2Cl2 | 浅黄色油状液体 | -80 | 138 | 遇水分解,高于100℃时开始分解 |
回答下列问题:


已知:TiO2不与碱反应,与酸反应后以TiO2+的形式存在。回答下列问题:

已知:
I:Cr(OH)3和Zn(OH)2是两性氢氧化物
II:室温下,Ni(OH)2的Ksp约为1.0×10-15
回答下列问题:
 )在工业上作磺胺类药物原料等,可通过苯胺和乙酸反应制得:
)在工业上作磺胺类药物原料等,可通过苯胺和乙酸反应制得: 已知:纯乙酰苯胺是白色片状晶体,熔点为114℃;微溶于冷水,可溶于热水,易溶于有机溶剂;加热时易被氧化。
实验室制备乙酰苯胺的步骤如下(部分装置省略):
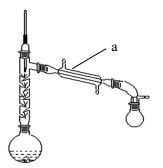
Ⅰ.粗乙酰苯胺的制备
在150mL 烧瓶中加入15mL(过量)乙酸(沸点117.9℃)、少量Zn粉和10mL(0.11mol)新制得的苯胺,如图接好装置。在石棉网上用小火加热,控制顶端馏出温度105℃左右使之充分反应1h。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有250mL冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用洗涤晶体2~3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。
Ⅱ.乙酰苯胺的提纯
将上述制得的粗乙酰苯胺固体移入500mL烧杯中,加入100mL热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸5min,趁热过滤。待滤液冷却至室温,有晶体析出,称量产品为11.2g。
回答下列问题:

请回答下列问题:


已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Ni2+ | Co2+ |
| 开始沉淀的pH | 6.3 | 1.5 | 3.4 | 6.2 | 7.15 |
| 沉淀完全的pH | 8.3 | 2.8 | 4.7 | 8.9 | 9.15 |

溶液中Ni2+离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ |
| 开始沉淀时(c=0.01mol·L-1)的pH | 7.2 |
| 沉淀完全时(c=1.0×10-5mol·L-1)的pH | 8.7 |
回答下列问题:
 请回答下列问题:
请回答下列问题:

某校化学兴趣小组根据该流程在实验室中进行实验。回答下列问题:

有关物质的部分性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
请按要求回答下列问题:
已知:①常温下ClO2为黄绿色气体,其熔点为-59℃,沸点为11.0℃,能溶于水,不与水反应。②温度过高,ClO2的水溶液可能爆炸。
实验室利用如图所示装置模拟工业NaClO3与Na2SO3在浓H2SO4存在下制备ClO2 , 并以ClO2为原料制备NaClO2(已知:高于60℃时,NaClO2分解生成NaClO3和NaCl)。


已知:铍及其化合物具有与铝及其化合物相似的化学性质。回答下列问题:
 已知:i.叠氮化钠受热或剧烈撞击易分解,具有较强的还原性。
已知:i.叠氮化钠受热或剧烈撞击易分解,具有较强的还原性。
ii.相关物质的物理性质如下表:
| 相关物质 | 熔点℃ | 沸点℃ | 溶解性 |
| CH3OH | -97 | 67.1 | 与水互溶 |
| 亚硝酸甲酯(CH3ONO) | -17 | -12 | 溶于乙醇、乙醚 |
| 水合肼(N2H4·H2O) | -40 | 118.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
| NaN3 | 275 | 300 | 与水互溶,微溶于乙醇,不溶于乙醚 |

已知:①“酸浸”时V2O5和V2O4先与稀硫酸反应分别生成VO 和VO2+。
②有机萃取剂萃取VO2+的能力比萃取VO 的能力强。
③溶液中VO 与VO
可相互转化:VO
+H2O
VO
+2H+。


