选择题
试题详情
一种钴的氧化物在纳米储能领域研究广泛,其晶胞结构如图所示(白球为Co,黑球为O),已知该晶胞参数为 , 阿伏加德罗常数为
, 阿伏加德罗常数为 。下列说法错误的是
。下列说法错误的是

- A、 该晶体的化学式为CoO
- B、 基态Co原子有3个未成对电子
- C、 与O原子最近且等距离的O原子有12个
- D、 氧化物的摩尔体积
试题详情
设 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是

- A、
中含有的配位键数为22NA
- B、 铬晶胞如图所示,
铬能切割成如图晶胞的数目为NA
- C、
参与氧化还原反应时,转移的电子数一定为2NA
- D、
溶液中含有的
数为0.1NA
试题详情
一种钙镁矿的四方晶胞结构如图所示。已知该晶胞的参数为apm、apm、bpm,1号原子的坐标为( ,
,  ,
,  ),下列说法错误的是
),下列说法错误的是

- A、 2号原子的坐标为(
,
,
)
- B、 距离硫原子最近的硫原子数目为4
- C、 硫原子的配位数为4
- D、 该晶体的密度为
g/cm3
试题详情
砷化镓是一种立方晶系如图甲所示,将Mn掺杂到晶体中得到稀磁性半导体材料如图乙所示,砷化镓的晶胞参数为x pm,密度为 。下列说法错误的是
。下列说法错误的是


- A、
砷化镓中配位键的数目是
- B、 Ga和As的最近距离是
- C、 沿体对角线a→b方向投影图如丙,若c在11处,则As的位置为7、9、11、13
- D、 Mn掺杂到砷化镓晶体中,和Mn最近且等距离的As的数目为6
试题详情
冰晶石 晶胞结构如图甲所示,Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示。下列说法错误的是
晶胞结构如图甲所示,Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示。下列说法错误的是

- A、 甲图中大立方体的体心处小三角“△”所代表的应该是“小白球”
- B、 Al晶胞中Al原子的配位数为12
- C、 若已知Al的原子半径为dcm,
代表阿伏加德罗常数,Al的相对原子质量为M,Al晶体的密度为
- D、
中含有离子键、配位键
试题详情
我国科学家开发铜钯催化剂高效实现电催化 还原制备乙酸,铜钯晶胞如图。已知:
还原制备乙酸,铜钯晶胞如图。已知: 、
、 的原子半径分别为a pm,b pm。下列叙述正确的是
的原子半径分别为a pm,b pm。下列叙述正确的是

- A、 乙酸的同分异构体均易溶于水
- B、 该晶胞的化学式为
- C、 离
最近的
有8个
- D、 该晶体的密度
试题详情
氮化镓是一种优异的半导体,硬度很大,熔点约为1700℃,氮化镓有三种晶体结构,其中最稳定的结构如图。下列关于该结构及其对应晶体的说法正确的是

- A、 氮化镓晶体属于分子晶体
- B、 该结构中有8个N原子
- C、 Ga原子周围等距且最近的Ga原子数为6
- D、 该晶体的密度为
×1030g•cm-3
试题详情
某立方品系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构,图b表示晶胞的一部分,晶胞中1号、3号原子的分数坐标分别为(0,0,0)、(1,1,1)。下列说法错误的是

- A、 晶胞中含有的Sb原子数为4
- B、 2号原子的分数坐标为
- C、 K和Sb之间的最短距离为
pm
- D、 该晶体的密度为
试题详情
硒化锌是一种重要的半导体材料;其晶胞结构如图甲所示,已知晶胞参数为pnm,乙图为晶胞的俯视图,下列说法正确的是

- A、 晶胞中硒原子的配位数为12
- B、 晶胞中d点原子分数坐标为
- C、 相邻两个Zn原子的最短距离为
nm
- D、 电负性:Zn>Se
多选题
试题详情
下列有关说法不正确的是( )

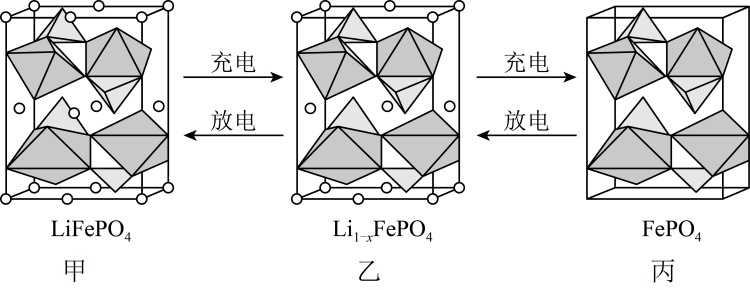
试题详情  的晶胞结构示意图如图甲所示,其中Li位于立方体的顶点、部分棱心和面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时,
的晶胞结构示意图如图甲所示,其中Li位于立方体的顶点、部分棱心和面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时, 脱出部分
脱出部分 , 形成乙、丙。下列说法错误的是
, 形成乙、丙。下列说法错误的是
试题详情
某镁铝尖晶石的晶胞由立方体M区和N区组成,结构如图。

下列说法正确的是( )
试题详情
硒化锌是一种黄色立方晶系,可用于荧光材料、半导体掺杂物。其晶胞结构如图,晶胞参数为 a pm。下列说法正确的是( )

试题详情
下列有关说法错误的是( )

非选择题
试题详情
中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物( )。回答下列问题:
)。回答下列问题:
试题详情
氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
试题详情
将酞菁—钴钛—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:
试题详情
硅材料在生活中占有重要地位。请回答:
试题详情
硫铁化合物( 、
、 等)应用广泛。
等)应用广泛。
试题详情
磷及其化合物在工业生产中起着重要的作用。
试题详情
某软锰矿含锰为50%,是重要的锰矿石。其主要成分如表:
软锰矿主要成分 | 杂质 |
MnO2 | MgO、FeO、Fe2O3、Al2O3、SiO2等杂质 |
某科研团队设计制备高纯度MnCO3。反应原理为①MnO2+BaS+H2O=MnO+Ba(OH)2+S;②MnO+H2SO4=MnSO4+H2O;③硫酸锰+碳酸氢铵+一水合氨→MnCO3↓(白色)。工艺流程图如图。
回答下列问题:
试题详情
硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物等领域具有重要应用。
试题详情
在科研和工农业生产中,碳、氮、砷(As)、铜等元素形成的单质及其化合物有着广泛的应用。回答下列问题:
试题详情
锗(Ge)是门捷列夫在1871年所预言的元素“亚硅”,高纯度的锗已成为目前重要的半导体材料,其化合物在治疗癌症方面也有着独特的功效。如图是以锗锌矿(主要成分为GeO2、ZnS,另外含有少量的Fe2O3等)为主要原料生产高纯度锗的工艺流程:

已知:GeO2可溶于强碱溶液,生成锗酸盐;GeCl4的熔点为-49.5℃,沸点为84℃,在水中或酸的稀溶液中易水解。
试题详情
二甲基亚砜( )是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
)是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
 )是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
)是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题: 试题详情
含银卤化物胶片是摄影中常用的感光材料。回答下列问题:
试题详情
分子人工光合作用的光捕获原理如图所示,WOC₁是水氧化催化剂WOC在水氧化过程中产生的中间体,HEC₁是析氢催化剂HEC在析氢过程中产生的中间体。

回答下列问题:
试题详情
镍铜合金是由60%镍、33%铜、7%铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐蚀性强,耐磨性好,容易加工,可作为航空发动机的结构材料。根据所学知识,回答下列问题:
试题详情
配合物是近代无机化学的重要研究对象,Fe、Cu等过渡元素常作为中心原子或离子,而H2O、Cl-、吡啶(C5H5N)等微粒则是常见的配体。



