选择题
试题详情
下列说法正确的是( )
- A、 工业上通过电解六水合氯化镁制取金属镁
- B、 接触法制硫酸时,煅烧黄铁矿以得到三氧化硫
- C、 浓硝酸与铁在常温下不反应,所以可用铁质容器贮运浓硝酸
- D、 “洁厕灵”(主要成分为盐酸)和“84消毒液”(主要成分为次氯酸钠)不能混用
试题详情
硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注,下列说法正确的是( )
- A、 NO2和SO2均为红棕色且有刺激性气味的气体,是酸雨的主要成因
- B、 汽车尾气中的主要大气污染物为NO、SO2和PM2.5
- C、 植物直接吸收利用空气中的NO和NO2作为肥料,实现氮的固定
- D、 工业废气中的SO2可采用石灰法进行脱除
试题详情
化学与生活、生产密切相关。下列说法中正确的是
- A、 以木材、秸秆等为原料,经加工处理可以得到合成纤维
- B、 植物从土壤中吸收
、NO转化为氨基酸的过程属于氮的固定
- C、 低温石英具有手性,被广泛用作压电材料,如制作石英手表
- D、 “杯酚”分离
和
, 体现了超分子的自组装的重要特性
试题详情
下列说法错误的是( )
- A、 某些胶态金属氧化物分散于玻璃中可制造有色玻璃
- B、 通常以海水提取粗食盐后的母液为原料制取溴
- C、 生物炼铜中通常利用某些细菌把不溶性的硫化铜转化为可溶性铜盐
- D、 工业制备硝酸的主要设备为沸腾炉、接触室和吸收塔
试题详情
工业上制取浓硝酸涉及下列反应:
①
②
③
下列有关工业制取浓硝酸反应的说法错误的是( )
- A、 反应①达到平衡时
- B、 使用高效催化剂能提高反应①中NO的平衡转化率
- C、 反应②在一定温度下能自发进行,则正反应为放热反应
- D、 标准状况下,反应③中每消耗22.4LO2 , 转移电子的数目约为
试题详情
下列化学用语对事实的表述错误的是( )
- A、 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH
C17H35COOC2H5+H218O
- B、 常温时,0.1mol·L-1氨水的pH=11.1:NH3·H2O⇆NH4++OH-
- C、 由Na和Cl形成离子键的过程:

- D、 电解精炼铜的阴极反应:Cu2+ +2e=Cu
试题详情
规范的实验操作是实验成功的必要保证,下列有关实验操作描述正确的是( )
- A、 电解精炼铜时,粗铜作阴极
- B、 容量瓶和分液漏斗使用前均需查漏
- C、 滴定实验前,需用所盛装溶液分别润洗滴定管和锥形瓶
- D、 试管和烧杯均可用酒精灯直接加热
试题详情
印刷电路板(PCB)是用腐蚀液将覆铜板上的部分铜腐蚀掉而制得。一种用FeCl3溶液制作PCB并将腐蚀后废液回收再生的流程如图:

下列说法错误的是( )
- A、 腐蚀池中发生反应的化学方程式是:Cu+2FeCl3=CuCl2+2FeCl2
- B、 腐蚀后的废液中,主要的金属阳离子有Fe3+、Cu2+、Fe2+
- C、 置换池中发生的主要反应为:Fe+Cu2+=Cu+Fe2+和Fe+2Fe3+=3Fe2+
- D、 再生池中加入酸化的H2O2 , 反应过程中pH降低
试题详情
下列说法不正确的是( )
- A、 应避免铵态氮肥与草木灰混合施用
- B、 工业上可用离子交换法提高海带中碘的提取率
- C、 电解饱和食盐水可以得到金属钠和氯气
- D、 将生铁进一步炼制减少含碳量,能得到耐腐蚀的钢
试题详情
下列说法正确的是( )
- A、 将粗硅在高温下与氯气作用生成
, 再用氢气还原
得到高纯度的硅
- B、 工业上通过电解
水溶液制金属镁
- C、 工业上以海带为原料制碘时,利用
萃取碘水中的碘,分液、蒸馏获得粗碘
- D、 炼铁时,加入石灰石的主要作用是分解提供
, 便于与C作用生成CO
试题详情
下列说法错误的是( )
- A、 工业上以氯气和石灰乳为原料制取漂白粉
- B、 75% (体积分数)酒精溶液能使蛋白质变性,其消毒效果比无水酒精好
- C、 钠是一种强还原剂,可用于制取钛、铌等金属
- D、 在工业炼铁中,焦炭的作用是直接还原铁矿石
试题详情
铝电解厂烟气净化的一种简单流程如下,下列说法正确的是( )

- A、 可用陶瓷等硅酸盐产品作吸收塔内衬材料
- B、 采用溶液喷淋法可提高吸收塔内烟气吸收效率
- C、 合成槽中
会随着合成的进行而不断减小
- D、 冰晶石可作为电解熔融氯化铝制铝时的助熔剂
试题详情
一种清洁、低成本的三步法氯碱工艺的工作原理如下图所示。下列说法错误的是( )

- A、 与传统氯碱工艺相比,该方法可避免使用离子交换膜
- B、 第一步中当消耗标况下
时,右侧电极质量减小
- C、 第二步中,放电结束后,电解质溶液中
的含量增大
- D、 第三步的总反应为:
非选择题
试题详情
Li-SOCl2电池采用LiAlCl4的SOCl2溶液为电解质溶液,是目前比能量最高的化学电源,具有电压高.储存寿命长.工作温度范围宽.成本低等优点。
试题详情
硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.

试题详情
根据题意填空:
试题详情
合成NH3是重要的研究课题,一种合成NH3的流程示意如图。

相关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 分解温度/℃ |
Mg | 649 | 1090 | >300 | Mg3N2:>800 |
已知:Mg3N2溶于水发生反应Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
试题详情
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解,易水解,可用作肥料、灭火剂、洗涤剂等。实验室制备氨基甲酸铵的反应如下:2NH3(g)+CO2(g)  NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:
NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:

步骤1:按图连接好实验装置,……………………….。
步骤2:在相应仪器中装入药品,其中1在三颈烧瓶中加入足量的氢氧化钠固体,在恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品。
……
请回答下列问题:
试题详情
S、N元素是重要的非金属元素,其化合物应用广泛。
试题详情
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
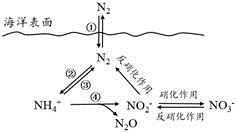
试题详情
合成氨是目前最有效工业固氮的方法,解决数亿人口生存问题。回答下列问题:
试题详情
工业上用氨催化氧化制硝酸
试题详情
工业上制取硝酸铵的流程图如下,请回答下列问题:

试题详情
对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝(  )、钼(
)、钼(  )、镍(
)、镍(  )等元素的氧化物,一种回收利用工艺的部分流程如下:
)等元素的氧化物,一种回收利用工艺的部分流程如下:
 已知:25℃时,
已知:25℃时, 的
,
;
;
;该工艺中,
时,溶液中
元素以
的形态存在。
试题详情
纯碱是重要的化工原料。我国科学家侯德榜发明的“侯氏制碱法”打破了西方对我国的技术封锁。某实验小组同学利用下图装置,模拟“侯氏制碱法”的部分流程。

已知:NaCl、NH4HCO3、NaHCO3、NH4Cl四种盐在不同温度下的溶解度如下表所示:
温度溶解度(g) 物质 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ |
NaCl | 35.8 | 36.0 | 36.3. | 36.6 | 37.0 | 37.3 | 37.8 |
NH4HCO3 | 15.8. | 21.0 | 27.0 | 一 | 一 | — | — |
NaHCO3 | 8.15 | 9.6 | 11.1 | 12.7 | 14.45 | 。16.4 | 一 |
NH4Cl | 33.3 | 37.2 | 41.1 | 45.8 | 50.4 | 55.2 | 60.2 |
回答下列问题:
试题详情
“氯碱工业”以电解饱和食盐水为基础制取氯气等产品, 氯气是实验室和工业上的常用气体。请回答:



