选择题
实验方案 | 现象 | 结论 | |
A | 往 | 短时间内无明显现象 |
|
B | 往 | 溶液先变成血红色后无明显变化 |
|
C | 将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加 | 溶液呈浅绿色 | 食品脱氧剂样品中没有 |
D | 向沸水中逐滴加5~6滴饱和 | 溶液先变成红褐色再析出沉淀 |
|
- A、 A
- B、 B
- C、 C
- D、 D
选项 | 探究方案 | 探究目的 |
A | 向盛有 |
|
B | 向盛有 |
|
C | 向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 |
|
D | 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 |
|
- A、 A
- B、 B
- C、 C
- D、 D
选项 | 实验操作及现象 | 结论 |
A | 将Na2S2O3溶液和稀H2SO4混合,得到沉淀,且生成的气体可使品红溶液褪色 | Na2S2O3既体现还原性又体现氧化性 |
B | 将Zn(OH)2固体粉末加入过量NaOH溶液中,充分搅拌,溶解得到无色溶液 | Zn(OH)2既体现碱性又体现酸性 |
C | 将TiCl4液体和FeCl3固体分别暴露在潮湿空气中,只有前者会冒“白烟” | 水解性:TiCl4>FeCl3 |
D | 将红色固体CrO3加热,得到绿色固体Cr2O3 , 且生成的气体可以使带火星的木条复燃 | 热稳定性:CrO3<Cr2O3 |
- A、 A
- B、 B
- C、 C
- D、 D
| 选项 | 实验方案 | 现象 | 结论 |
| A | 室温下,向苯酚浊液中加入碳酸钠溶液 | 溶液变澄清 | 酸性: |
| B | 向做过银镜反应的试管中加入足量氨水 | 银镜逐渐消失 | 银能与氨形成溶于水的配离子 |
| C |
| 酸性 |
|
| D | 向某溶液中加入稀硫酸 | 产生淡黄色沉淀,同时生成能使品红溶液褪色的无色气体 | 该溶液中含有 |
- A、 A
- B、 B
- C、 C
- D、 D
- A、 将铁钉浸没在
溶液中可验证铁的析氢腐蚀
- B、 模拟“侯氏制碱”时,应向饱和
溶液中先通入
再通入
- C、 进行粗盐提纯时,可向上层清液中继续滴加2~3滴
溶液以检验
是否除尽
- D、 配制一定物质的量浓度的
溶液时,若加水超过刻度线,应将多余液吸出
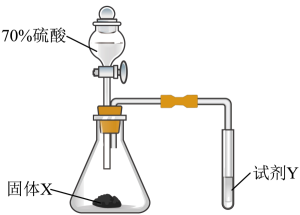
- A、 固体X可为Cu
- B、 若试剂Y为氢硫酸,则试管中可产生淡黄色沉淀
- C、 为证明
具有还原性,试剂Y可为酸性
溶液
- D、 该装置中试管口应塞一团浸有
溶液的棉团
- A、 ①中“过滤”所得的滤液中含有Zn2+
- B、 ②中“氧化”时加入的NaClO要过量
- C、 ③中“分离”操作中包括过滤
- D、 Fe3O4胶体粒子的产率为
选项 | 实验目的 | 实验方案设计 | 现象和结论 |
A | 制备Fe(OH)3胶体 | 向5 mL NaOH溶液中滴加2滴FeCl3饱和溶液,煮沸 | 溶液变红褐色;说明有Fe(OH)3胶体生成 |
B | 验证铁的电化学腐蚀 | 在一 块除去铁锈的铁片上面滴1滴含有酚酞的食盐水,静置2~3 min | 溶液边缘 出现红色;说明铁发生了吸氧腐蚀 |
C | 探究SO2的还原性 | 将SO2通入适量品红溶液中 | 溶液褪色:说明SO2具有还原性 |
D | 比较C与Cl的非金属性强弱 | 用pH试纸测定1mol/L的Na2CO3和NaClO溶液的pH | 前者的试纸颜色比后者深; 说明非金属性Cl>C |
- A、 A
- B、 B
- C、 C
- D、 D
某科研小组探究Fe与能否直接反应的实验如下:
实验1:取加热至沸腾并快速冷却的溶液(加热、冷却过程中溶液颜色无变化)于试管中,并加入1mL的苯,再加入铁粉,长时间无蓝色沉淀出现。
实验2:在“实验1”中,若使用砂纸打磨过的铁粉,一会儿就出现蓝色沉淀。
实验3:在“实验1”中,若加少量NaCl,立即出现蓝色沉淀;若换成加入或
;则不出现蓝色沉淀。
实验4:在“实验1”中,若将铁粉换成在稀硫酸中反应一段时间的铁片,立即出现蓝色沉淀。
下列说法错误的是
- A、 实验1中长时间无蓝色沉淀出现,可能是因为铁粉表面有氧化膜
- B、
可能起破坏铁粉表面氧化膜的作用
- C、 Fe与
可以直接反应
- D、 在Fe、C、NaCl溶液组成的原电池中,通过直接滴加
溶液至电解质溶液中的方法,可以检验是否发生原电池反应
选项 | 目的 | 方案设计 | 现象和结论 |
A | 探究温度对化学平衡的影响 | 将2mL0.5mol/L的CuCl2溶液加热后置于冷水中,观察现象 | 若溶液由黄绿色变为蓝绿色,说明降低温度,[Cu(H2O)4]2++4Cl- |
B | 检验食品脱氧剂中还原铁粉是否已变质 | 取脱氧剂包装内固体粉末于试管中,加足量稀盐酸溶解,充分反应后滴加KSCN溶液,振荡,观察溶液颜色变化 | 若溶液未变红色,说明脱氧剂中还原铁粉没有变质 |
C | 比较CH3COO-和ClO-水解程度大小 | 用pH试纸分别测定同浓度CH3COONa和NaClO溶液的pH | 若测得CH3COONa溶液pH大,说明CH3COO-水解程度大于ClO- |
D | 探究电石与水的反应 | 将电石与饱和食盐水反应产生的气体通入酸性高锰酸钾溶液,观察现象 | 若酸性高锰酸钾溶液褪色,说明电石与水反应生成了乙炔 |
- A、 A
- B、 B
- C、 C
- D、 D
选项 | 实验目的 | 实验过程 |
A | 检验某铁的氧化物含二价铁 | 将该氧化物溶于浓盐酸,滴入KMnO4溶液,紫色褪去 |
B | 检验乙醇中含有水 | 向乙醇中加入一小粒金属钠,产生无色气体 |
C | 证明酸性:H2SO3>HClO | 在Ca(ClO)2溶液中通入SO2 , 产生白色沉淀 |
D | 证明:CO2有氧化性 | 将点燃的镁条,迅速伸入盛满CO2的集气瓶中,产生大量白烟且瓶内有黑色颗粒产生 |
- A、 A
- B、 B
- C、 C
- D、 D

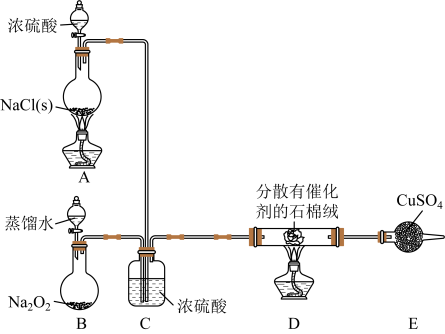
- A、 该实验中FeCl3的产率为60%
- B、 装置C,H中的药品可以都为P2O5
- C、 装置B用于干燥氯气,装置E和G用于收集产物
- D、 可用K4[Fe(CN)6]溶液检验FeCl3产品中是否存在FeCl2

- A、 a中可以用Na2CO3和稀盐酸来制备CO2
- B、 b装置中是饱和Na2CO3溶液,作用是除去a中产生的HCl
- C、 c中只发生2Na2O2 +2CO2=2Na2CO3+O2
- D、 f中收集的气体是纯净的O2


- A、 图1氨气的制备
- B、 图2制备少量蒸馏水
- C、 图3乙酸乙酯的制备
- D、 图4测定锌与稀硫酸反应生成氢气的速率
实验方案 | 现象 | 结论 | |
A | 测定均为离子化合物的 |
|
|
B | 常温下,测定 |
| |
C | 向 |
|
|
D | 向 | 产生淡黄色沉淀 |
|
- A、 A
- B、 B
- C、 C
- D、 D
选项 | 实验 | 现象 | 结论 |
A | 向食品脱氧剂样品(含还原铁粉)中加入硫酸后滴加酸性 | 紫红色褪去 | 食品脱氧剂样品中含 |
B | 向 | 加入 |
|
C | 向 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
D | 向 | 溶液变为蓝色 | 氧化性: |
- A、 A
- B、 B
- C、 C
- D、 D
- A、 向酸性高锰酸钾溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中有Fe(II)
- B、 向Na2X溶液中缓慢滴加少量稀醋酸,无明显现象,证明酸性:H2X>CH3COOH
- C、 常温下,用玻璃棒蘸取某盐溶液滴在pH试纸中央,然后与标准比色卡对比,溶液的pH=7,该盐属于强酸强碱盐
- D、 向NaBr溶液中滴加过量氯水,再加入淀粉-KI溶液,溶液先变橙色,后变蓝色,说明氧化性:Cl2>Br2>I2

- A、 装置e 的作用是防倒吸
- B、 根据图a的现象判断活塞K一定处于关闭状态
- C、 实验结束时,先关闭活塞K,再熄灭酒精灯
- D、 b、c、f 中的试剂依次为饱和碳酸钠溶液、浓硫酸、银氨溶液

选项 | Ⅰ处试剂 | Ⅱ处用品 | Ⅱ处实验现象 |
A | NH4Cl | 湿润的蓝色石蕊试纸 | Ⅰ处产生白烟,Ⅱ处蓝色石蕊试纸变红 |
B | Cu2( OH)2CO3 | 过氧化钠粉末 | Ⅰ处由绿色变黑色,Ⅱ处由淡黄色变白色 |
C | KClO3 | 湿润的淀粉试纸 | Ⅰ处无明显现象,Ⅱ处淀粉试纸变蓝 |
D | 氧化铁和碳粉的混合物 | 氧化铜粉末 | Ⅰ处由黑色变银白色,Ⅱ处由黑色变红色 |
- A、 A
- B、 B
- C、 C
- D、 D

- A、 使反应发生的操作是将a中的Y形管向右倾斜
- B、 装置b中出现白色沉淀,可能是BaCO3或BaSO3
- C、 装置d中出现浑浊,证明产生的气体中含有CO2
- D、 装置e中可以盛放NaOH溶液,f的作用为防倒吸
- A、 向NaHCO3溶液中加入AlCl3溶液,产生白色沉淀并有无色气泡生成
- B、 向Ba(NO3)2溶液中通入足量的SO2气体,溶液先变浑浊,然后重新变清澈
- C、 向NH4Cl溶液中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝
- D、 在光照条件下,将盛有CH4和Cl2的试管倒扣于盛有饱和食盐水的烧杯中,混合气体黄绿色逐渐变浅,试管内有油状液体出现,试管内液面上升
编号 | 1 | 2 |
实验内容 |
|
|
实验现象 | 随着液体不断滴入,产生大量气体;溶液变黄并不断加深至棕黄色后又变浅 | 随着液体不断滴入,溶液变黄,摇匀后又褪色,不断重复直至析出紫色沉淀 |
下列说法错误的是
- A、 实验1中溶液变浅是因为
- B、 实验2中出现紫色沉淀是因为
- C、 实验1中产生大量气体的原因是
被氧化的过程大量放热
- D、 实验2相较于实验1,可节约H2O2用量且有利于反应终点观察
多选题
选项 | 实验方案 | 现象 | 结论 |
A | 向紫色石蕊溶液中通入过量二氧化硫 | 溶液先变红后褪色 |
|
B | 向 | 产生黑色沉淀 | 静置后的上层清液中有 |
C | 向某溶液中先滴加适量稀硝酸,再滴加少量 | 开始无明显现象,后出现白色沉淀 | 原溶液中含有 |
D | 室温下用pH试纸分别测定浓度均为 | pH: | 结合 |
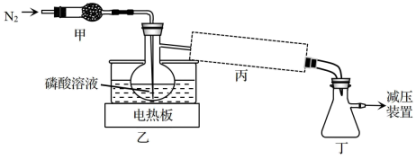

a | b | c | |
A | 饱和食盐水 | ||
B |
| ||
C |
| ||
D |
|
非选择题
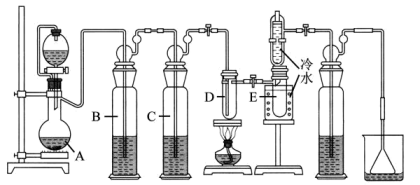
【相关药品性质】
药品 | 颜色、状态 | 熔点(℃) | 沸点(℃) | 其他性质 |
银白色固体 | 231 | 2260 | 较活泼金属能与 | |
无色液体 | 114 | 极易水解产生 |
请回答下列问题:
资料:高铜酸钠为棕黑色固体,难溶于水。
实验Ⅰ.向2mL1mol/LNaClO溶液中滴加1mL1mol/LCuCl2溶液,迅速产生蓝绿色沉淀,振荡后得到棕黑色的浊液a,将其等分成2份。

已知: I.制备HSbF6的相关反应为SbCl3+ Cl2SbCl5;SbCl5+ 6HF = HSbF6+ 5HCl
II.毛细管连通大气,装置内减压时可吸入极少量的空气,产生微小气泡以代替沸石。
III.相关物质的部分性质如下:
物质 | 熔点 | 沸点 | 其他性质 |
SbCl3 | 73.4℃ | 220.3℃ | 极易水解 |
SbCl5 | 3.5℃ | 79℃/2.9 kPa; 140℃、101 kPa开始分解 | 极易水解 |
已知:
i.在一定条件下可被还原为:
(绿色)、
(无色)、
(棕黑色)。
ii.在中性、酸性溶液中不稳定,易发生歧化反应,产生棕黑色沉淀,溶液变为紫色。
实验 | 序号 | 物质a | 实验现象 |
4滴物质a 6滴(约0.3mL)0.1
2mL0.01 | I | 3 | 紫色溶液变浅至几乎无色 |
II | 紫色褪去,产生棕黑色沉淀 | ||
III | 6 | 溶液变绿,一段时间后绿色消失,产生棕黑色沉淀 |
请回答下列问题:












