多选题
下列说法正确的是( )

下列说法正确的是





下列说法错误的是( )
| 实验 | c0(NO)/(mol·L-l) | c0(H2)/(mol·L-l) | v正 |
| 1 | 1 | 1 | v |
| 2 | 2 | 1 | 4v |
| 3 | 1 | 2 | 2v |
| 4 | 2 | x | 16v |

选择题

- A、
- B、 可计算
键能为
- C、 相同条件下,
的平衡转化率:历程Ⅱ>历程Ⅰ
- D、 历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:
| 温度/ | 85 | 95 | 100 | 110~240 | 280 | 300 | 340 | |
| 质量分数/% | 苯 | 96.05 | 91.55 | 80.85 | 1 | 23.35 | 36.90 | 72.37 |
| 环己烷 | 3.95 | 8.45 | 19.15 | 99 | 76.65 | 63.10 | 27.63 | |
下列说法不正确的是
- A、 该催化剂反应最佳反应温度范围是
, 因为催化剂的选择性和活性都比较高
- B、
以上苯的转化率下降,可能因为温度上升,平衡逆向移动
- C、 在
范围内,适当延长反应时间可以提高苯的转化率
- D、 在
范围内,温度上升反应速率加快,因此苯的转化率上升

- A、 Q点与P点的平衡常数大小为:
- B、
与
浓度比为1∶1时,标志此反应已达平衡
- C、 T℃时,
- D、 用CO的浓度变化表示曲线N在0~100s内的平均速率为

下列说法正确的是
- A、 反应Ⅰ的速率大于反应Ⅱ的速率
- B、 若原料用丙炔,则会有2种分子式为C6H10的有机物生成
- C、 增大Cu的表面积,可加快反应速率,提高C2H2的平衡转化率
- D、
转化成C4H6(g)过程中,有非极性键的断裂和形成
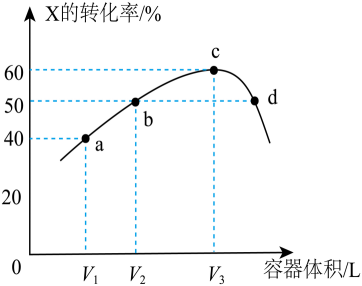
- A、 a点再充入一定量的X,X的转化率减小
- B、 d点有ν正=ν逆
- C、 正反应速率v(b)=v(d)
- D、 若c点为平衡点,则浓度平衡常数K=0.9
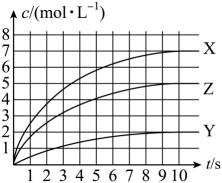
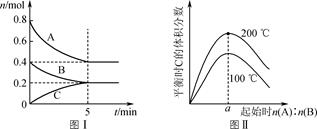
- A、 0~10s内,M的平均反应速率
- B、 温度不变,反应过程中
的值不变
- C、 反应①的活化能比反应②的活化能大
- D、 温度升高,体系中
的值减小

- A、
内,
- B、 温度升高,容器内气体的密度减小
- C、
℃,再投入
, 平衡时
- D、
0.25 | 0.50 | 1.00 | 0.50 | 1.00 | ||
0.050 | 0.050 | 0.100 | 0.100 | 0.200 | 0.200 | |
v/(mol-1∙L-1∙min-1) |
下列说法正确的是( )
- A、 该反应的速率方程中的
- B、 该反应的速率常数
- C、 表格中的
- D、 在过量的B存在时,反应掉93.75%的A所需的时间是
已知:时,该反应的化学平衡常数

- A、 若
时刻未改变外界条件,则此时该反应:
- B、 若
时刻反应达到平衡,则
时刻改变的条件可能为及时移除Ag
- C、 若始终保持温度不变,则逆反应速率:
- D、
内
的平均反应速率为

- A、 300℃时,0-5min内平均反应速率
- B、 b、c点对应的
(Y)大小关系:
- C、 c点时,反应消耗
molX(
),同时消耗
molZ
- D、 若将气体体积缩小为0.5L,则c点温度下的
(X)减小
非选择题
![]()
在298K下, 羟基丁酸水溶液的初始浓度为
,测得
丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
| | 21 | 50 | 80 | 100 | 120 | 160 | 220 | |
| | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
O2NC6H4COOC2H5+OH﹣⇌O2NC6H4COO﹣+C2H5OH
两种反应物的初始浓度均为0.050mol•L﹣1 , 15℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示.回答下列问题:
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
Ⅰ.
Ⅱ.
回答下列问题:
反应I:CO(g)+2H2(g)⇌CH3OH(g) +Q1
反应II:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) +Q2
下表所列数据是反应I在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
反应I:
反应II:
反应III:
反应IV:
反应V:
回答下列问题。
I.
II.
I.CH2=CHCH=CH2(g)+2H2(g)⇌CH3CH2CH2CH3(g) ∆H1
Il.CH3C≡CCH3(g)+2H2(g)⇌CH3CH2CH2CH3(g) ∆H2
III.CH3C≡CCH3(g)⇌CH2=CHCH=CH2(g) ∆H3
回答下列问题;