已知:氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl- , 在75℃以上和浓碱溶液中主要产物是ClO3-和Cl-

回答下列问题:
在NaBr和KSCN的混合溶液中滴加少量(CN)2 , 请写出发生反应的离子方程式。
I.上述反应的还原剂是
II.根据上述反应,鉴别某白色固体是NaNO2还是NaCl。可选用的物质有:①水 ②淀粉碘化钾试纸 ③淀粉溶液 ④白酒 ⑤食醋(稀的醋酸溶液),你认为必须选用的物质有(填字母)。
A .③⑤ B.①②⑤ C.①②④
III.某厂废液中,含有2%~5%的NaNO2直接排放会造成污染,下列试剂能使NaNO2转化为N2防止污染的是。(填字母)
A.NaCl B. C.
D.浓
ⅰ.当汽车发生较严重的碰撞时,引发分解
, 从而为气囊充气。产生的Na立即与
发生置换反应生成
, 化学方程式是。
ⅱ.是冷却剂,吸收产气过程释放的热量。
起冷却作用时发生反应的化学方程式为。
ⅲ.一个安全气囊通常装有 , 其完全分解所释放的
为mol。(保留两位小数)

已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入从而把熔点降至约580℃。
①把NaCl固体加热至熔融状态,目的是。
②粗钠中含有少量杂质Ca,过程Ⅱ除去Ca的化学方程式是。
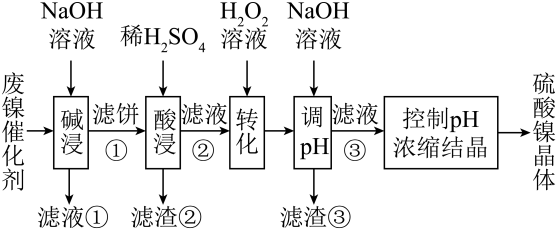
回答下列问题:
(填离子符号)