 C .
C . 
KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
|
N—N |
N≡N |
P—P |
P≡P |
|
193 |
946 |
197 |
489 |
从能量角度看,氮以N2、而白磷以P4(结构式可表示为  )形式存在的原因是。
)形式存在的原因是。
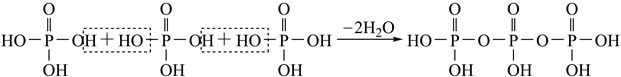 如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。
如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。

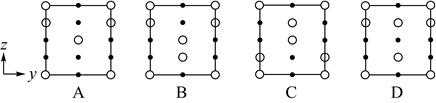
①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA , 晶体的密度__g•cm-3(写出表达式)。
②晶胞在x轴方向的投影图为__(填标号)。
在该反应中,B原子的杂化轨道类型由变为。

氨硼烷晶体的密度ρ=g·cm−3(列出计算式,设NA为阿伏加德罗常数的值)。
①PO的立体构型为。与PO
互为等电子体的分子为(任写一种,填化学式)。
②KTiPO4F中所含元素的第一电离能由大到小的顺序为(用元素符号表示)。
③一些氢化物的沸点如表所示:
氢化物 | PH3 | H2O | HF |
沸点/℃ | -87.5 | 100 | 19.5 |
解释表中氢化物之间沸点存在差异的原因:。



① 分子中有
键。
②与 互为等电子体的一种分子为(填分子式)。
③氨硼烷在高温下释放氢后生成的立方氮化硼晶体具有类似金刚石的结构,晶胞结构如图所示。它的硬度比金刚石低,原因是。设 为阿伏加德罗常数的值,若晶胞参数为
,则晶体密度为
(列出计算式)。



A.  B.
B. 
C.  D.
D. 

①B2H6分子结构如图,则B原子的杂化方式为。
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是,写出一种与氨硼烷互为等电子体的分子(填化学式)。

①固体氯化酰铬属于(填“极性”或“非极性”)分子,判断依据是。
②等电子体是具有相同的价电子数和原子数的分子或离子。写出一种与CCl4分子互为等电子体的阴离子:(填化学式);写出CS2分子的电子式:。
①氮化铬的熔点比氯化钠高的主要原因是。
②与Cr3+次邻近的N3–有个。
③已知Cr3+和N3–半径分别为apm、bpm,设Cr3+和N3–都是紧密接触的刚性小球,NA代表阿伏加德罗常数的值,晶体的密度为ρg•cm–3 , 则CrN的摩尔质量为。(用含a、b、NA、ρ的算式表示)

①组成该物的质元素中,电负性最大的是(填元素符号)
②M中不含(填标号)
a.π键 b.σ键 c.配位键 d.离子键 e.氢键



①砷化镓的化学式为,镓原子的配位数为。
②砷化镓的晶胞密度=g/cm3(列式并计算,精确到小数点后两位),m位置Ga原子与n位置As原子之间的距离为pm(列式表示)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
画出溶液中[Zn(OH)2Cl2]2-的结构式,并表示出配位键。

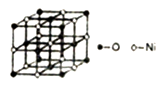
①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的体空隙中。
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm,则熔点MgONiO(填“>”、“<”或“=”),理由是。
钒和镍及其化合物是重要合金材料和催化剂,其储氨合金可作为一种新型锌离子电池的负极材料,该电池以Zn(Cl3SO3)2 为电解质,以有缺陷的阳离子型ZnMn2O4 为电极,成功获得了稳定的大功率电流。
①H2O2分子中O原子的杂化方式为。
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为。

①储氢前该镧镍合金的化学式为。
②该镧镍合金储氢后氢气的密度为(用NA表示阿伏加德罗常数的数值)g·cm-3。

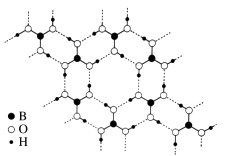
①1 mol H3BO3晶体中含有mol 氢键。
②请从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大的原因:。
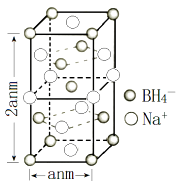
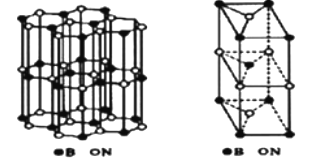
①该晶体中Na+的配位数为。
②H3BO3 分子中的 O—B—O 的键角(填“大于”、“等于”或“小于”) BH4-中的 H—B—H 的键角,判断依据是。
③已知硼氢化钠晶体的密度为 ρ g/cm3 , NA代表阿伏加德罗常数的值,则 a=(用含 ρ、 NA的代数式表示);④若硼氢化钠晶胞上下底心处的 Na+被 Li+取代,得到的晶体的化学式为。
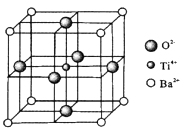
①与钡离子等距离且最近的氧离子有个;
②假设晶体中的Ti4+、Ba2+分别与O2-互相接触,则该晶体的密度表达式为g.cm-3。
①Ni(CO)4熔点为-19.3℃,沸点43℃,则其熔、沸点较低的原因是。
②其分子中σ键与π键数目之比为。
③写出一种与配体CO互为等电子体的阴离子符号。
④[Ni(NH3)6]2+中配体NH3中N原子的杂化类型为,若[Ni(NH3)6]2+为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有种。

A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
画出溶液中[Zn(OH)2Cl2]2-的结构式,并表示出配位键。
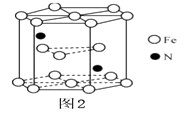 ,Fe为堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为
,Fe为堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为 
①距离最近的两个Cu+间的距离为nm。(保留两位小数)
②Cu3N 晶体的密度为 g·cm-3。(NA表示阿伏加德罗常数的值,列出计算式,不必计算出结果)


①BAs晶体中,As的杂化形式为.
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有(填字母)。
A.离子键
B.金属键
C.极性键
D.氢键 E.配位键 F.σ键 G.π键
③BAs晶体的晶胞参数为bpm,则其晶体的密度为(列出表达式,设NA为阿伏加德罗常数的数值)g/cm3。

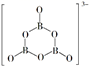
①与SO42-互为等电子体的阴离子化学式为(写出一种)
②氨的热稳定性强于膦(PH3),原因是。
