
已知:i.pH越大,越小;
ii.酸性条件下被还原为
下列说法不合理的是

已知:①CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4Cl
②Ca(OH)2与H2O2直接反应,生成杂质较多。
下列说法不正确的是( )
实验序号 | I | II |
实验过程 | 滴加10滴(约0.3mL)0.1mol/L Na2S溶液
| 滴加10滴(约0.3mL)0.01mol/L酸性KMnO4溶液(H2SO4酸化至pH=0)
|
实验现象 | 紫色变浅(pH<1),生成棕褐色沉淀(MnO2) | 溶液呈淡黄色(pH≈8),生成浅粉色沉淀(MnS) |
资料:i.MnO在强酸性条件下被还原为Mn2+ , 在近中性条件下被还原为MnO2。
ii.单质硫可溶于硫化钠溶液,溶液呈淡黄色。下列说法正确的是( )
Al+NaNO3+NaOH=NaAlO2+N2+H2O。请配平该反应
上述反应中,元素的化合价升高,则该元素的原子 (填“得到”或“失去”)电子。用“单线桥法”表示反应中电子转移的方向和数目。

①滴定终点的现象为。
②计算该二氧化氯溶液中的物质的量浓度(写出计算过程)。
①SO3+H2O=H2SO4
②3NO2+H2O=2HNO3+NO
③2F2+2H2O=4HF+O2
④2Na+2H2O=2NaOH+H2↑
⑤Na2O+2HCl=2NaCl+H2O
⑥Al2O3+2NaOH=2NaAlO2+H2O
探究内容 | 实验方案 | 实验现象 |
探究Fe3+的化学性质 | 取少量0.1 mol ·L-1 FeCl3溶液,往溶液中加入 足量铁粉,再加入少量KSCN溶液 | 加入铁粉后 ,溶液颜色为 ; 加入KSCN溶液后,溶液颜色 |
结论:Fe3+具有性 | ||
①已知氧化性:>Fe3+ ,则X离子是。
②该反应的离子方程式是 。
①SeO2+KI+_HNO3=Se+I2+KNO3+H2O
②I2+2Na2S2O3=Na2S4O6+2NaI
配平化学方程①,并标出电子转移的方向和数目。
下列说法正确的有____(填字母)。
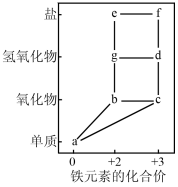
①写出g→d的化学方程式:。
②根据上述“价一类”二维图信息,下列说法正确的是(填字母)。
A.d胶体可用于饮用水消毒和净化
B.a转化为c只需控制纯氧的量即可实现
C.a→b→c→d之间的转化均可以通过一步反应实现
D.将a加入f的溶液中,溶液质量增加
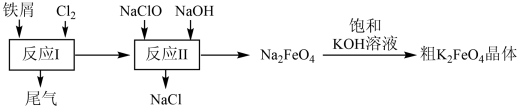
写出反应II的离子方程式:。
![]() H2S +
H2S + ![]() HNO3(稀) =
HNO3(稀) = ![]() H2O +
H2O + ![]() S↓+
S↓+ ![]() NO↑
NO↑