选项 | 现象预测 | 分析 |
A | CuSO4溶液呈天蓝色 | 溶液中含有[Cu(H2O)]2+ |
B | 加入少量氨水时产生白色沉淀 | 氨水呈碱性,可与Cu2+形成难溶的Cu(OH)2 |
C | 继续加入过量氨水,沉淀溶解,得到深蓝色透明溶液 | NH3中N配位能力较强,与Cu2+形成[Cu(NH3)4]2+ , 促进Cu(OH)2溶解,平衡向溶解方向移动 |
D | 继续加入乙醇并用玻璃棒摩擦试管壁,析出深蓝色晶体 | 乙醇极性较小,析出的深蓝色晶体是[Cu(NH3)4]SO4•H2O |

试剂 | 密度 | 沸点 |
|
乙醇 | 0.7893 | 78.5 | |
苯甲酸 | 1.2659 | 249 | |
环己烷 | 0.7785 | 80 | |
乙醚 | 0.7318 | 34.51 | |
苯甲酸乙酯 | 1.05 | 211~213 |
回答下列问题:

①毛细管的主要作用是。
②毛细管能否用碎瓷片代替(填“能”或“否”)。
③蒸馏中温度计的示数为(填标号)。
a.小于 b.小于
C.高于
低于
d.
e.高于
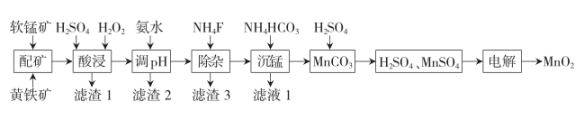
已知:①软锰矿与黄铁矿的主要成分分别为MnO2、FeS2 , 还含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的pH如下:
金属离子 | Fe2+ | Fe3+ | Mn2+ | Mg2+ | Al3+ |
开始沉淀pH | 6.9 | 1.9 | 6.6 | 9.1 | 3.4 |
沉淀完全(c=1.0×10-5mol·L-1)的pH | 8.3 | 3.2 | 10.1 | 10.9 | 4.7 |
回答下列问题:
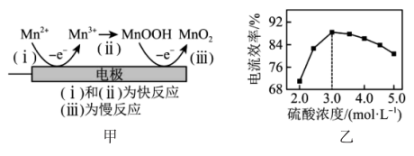

已知:i)  +
+![]()
![]() +R1OH
+R1OH
ii)2CH3CHO![]()
回答下列问题:
i)遇FeCl3溶液显色:
ii)能发生水解反应也能发生银镜反应:
iii)核磁共振氢谱显示有四组峰。
