1.
(2023高二下·湖口期末)
高品质MnO2可用于生产锂离子电池正极材料锰酸锂。以软锰矿与黄铁矿为主要原料,采用“两矿一步浸出法”制备高品质MnO2的工艺流程如下图所示:
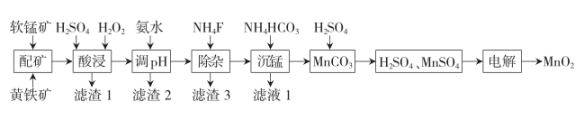
已知:①软锰矿与黄铁矿的主要成分分别为MnO2、FeS2 , 还含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的pH如下:
金属离子 | Fe2+ | Fe3+ | Mn2+ | Mg2+ | Al3+ |
开始沉淀pH | 6.9 | 1.9 | 6.6 | 9.1 | 3.4 |
沉淀完全(c=1.0×10-5mol·L-1)的pH | 8.3 | 3.2 | 10.1 | 10.9 | 4.7 |
回答下列问题:
-
-
-
(2)
“酸浸”操作中需先后分批加入H2SO4、H2O2。已知滤渣1的主要成分为S、SiO2、CaSO4等。加入H2SO4后发生反应生成单质S的离子方程式为。加入H2SO4后反应的生成物会附着在矿粉颗粒表面,使上述反应受阻,此时加入H2O2 , 利用其迅速分解产生的大量气泡可破除该不利影响。导致H2O2迅速分解的因素是。
-
-
(3)
“调pH”时调节溶液pH范围为4.7~6.0,此时“滤渣2”的主要成分为(填化学式)。
-
-
(4)
“除杂”时,溶液体系中的Ca
2+和Mg
2+形成氟化物沉淀。若沉淀后上层清液中c(F
-)=0.05mol·L
-1 , 则

[已知K
sp(MgF
2)=5.0×10
-11 , K
sp(CaF
2)=2.5×10
-9]。
-
-
-
-
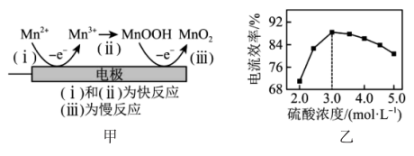
(6)
利用惰性电极电解H
2SO
4-MnSO
4-H
2O体系可获得MnO
2 , 阳极的电极反应式为
。电解过程的机理(部分)如图甲所示,硫酸浓度与电流效率的关系如图乙所示。硫酸浓度超过3.0mol/L时,电流效率降低的原因是
。
-

