文物 |
|
|
|
|
战国牛虎铜案 | 溪山行旅图 | 西汉滇王编钟 | 新石器时代鸡形陶壶 | |
选项 | A | B | C | D |
选项 | A | B | C | D |
操作 |
|
|
|
|
实验目的 | 制备氢氧化铁胶体 | 定容 | 除去 | 制备并收集 |
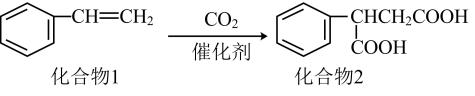
①
②
③
则④
(用含
、
、
的代数式表示)。实验室可用氯化铵与消石灰反应制备少量
:
, 该反应在(填“高温”、“低温”或“任何温度”)下能自发进行。
①。
②平衡时体系压强为 ,
为用分压表示的平衡常数(分压
总压
物质的量分数),则平衡常数
(用含p的式子表示)
。

①已知a、b的坐标参数依次为(0,0,0)、( ,
,
),则d的坐标参数为。
②晶胞边长为cpm,该晶体的密度为。(列计算式,设
为阿伏加德罗常数的数值)