
①时刻前,溶液中
减小速率较快,
时刻后,溶液中
基本不变,其原因是。
②预测时刻后,
的物质的量变化趋势,并在图中补充完整。

①电极b极为(填“正极”或“负极”),写出该电极的电极反应式:。
②电池工作时,经质子膜进入(填“a极”或“b极”)区。
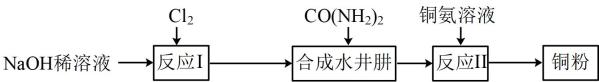

已知:①(棕色);
②都是难溶于水、难溶于稀硫酸的黑色固体。
实验中,观察到B中红色溶液变无色,C中产生白色沉淀,D中溶液变棕色。铜粉完全反应后,观察到烧瓶底部有灰白带黑色固体。
猜想1:白色固体是;
猜想2:白色固体是(填化学式);
猜想3:白色固体是和
。
为了确认白色固体成分,取少量白色固体于试管中,加入足量盐酸,白色固体不溶解且无气泡生成。由此推知,猜想(填数字)合理。
①若过量或恰好完全反应,则发生的离子反应为
;若
少量,则发生的离子反应为。
②设计实验证明C中盛装的是否过量:。
①分离应选择的合理操作是(填标号),过滤,得到蓝色溶液和黑色固体。
a.向混合物中加入蒸馏水,搅拌,静置
b.将混合物倒入盛有水的烧杯中,搅拌,静置
②黑色固体不可能是(填标号),判断依据是。
A. B.
C.
③探究上述黑色固体成分。

取所配制的溶液于锥形瓶中,滴几滴试剂R,用
的
标准溶液滴定至终点,消耗滴定液
。R是(填名称)。根据上述相关实验结果,X是(填化学式)。
Ⅱ.
kJ⋅mol
Ⅲ.
kJ⋅mol
则的
kJ⋅mol
, 该反应在(填“高温”、“低温”或“任意温度”)条件下自发。
①则0∼10min内,kPa⋅min
,该温度下,此反应的平衡常数
(kPa)2(以分压表示,结果保留一位小数)。
②上述条件下,下列情况能说明反应一定达到平衡状态的是 (填标号)。
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内
D.单位时间内,断开键的数目和断开
键的数目相同

由图可知,75 min后转化率与炭催化剂目数的关系为,原因是。