|
|
方案设计 |
现象和结论 |
|
A |
先加入少量KClO3溶液,再加 |
若产生白色沉淀,则样品为亚硝酸钠 |
|
B |
加到少量 |
若溶液褪色,则样品为亚硝酸钠 |
|
C |
先加到少量 |
若溶液变黄色,则样品为亚硝酸钠 |
|
D |
先加入少量 |
若产生白色沉淀,则样品为亚硝酸钠 |


①若控制温度、
, 则滤渣Ⅱ的主要成分为(填化学式)。
②若控制温度、
, 可得到黄铁矾钠
(图中阴影部分),写出生成黄铁矾钠的离子反应方程式。
I.称量镀镍试剂,配制
溶液A;
Ⅱ.准确量取溶液A,用
的
标准溶液滴定其中的
(离子方程式为
),消耗
标准溶液
;
Ⅲ.另取溶液A,加入足量的
溶液,得到白色沉淀
。
IV.取溶液A,加入足量的
溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体
①配制镀镍试剂时,除了药匙、天平、玻璃棒、量筒外,还需要仪器有。
②该镀镍试剂的化学式为。

①打开分液漏斗活塞,将水滴入烧瓶中②在相应装置中加入药品③检查装置气密性④加热 ⑤停止加热 ⑥关闭分液漏斗活塞

①仪器X的作用是。
②氨气在该反应中所起的作用是。
③实验结束后,得到纯净且干燥的具体操作为。
反应I:
反应Ⅱ:
反应Ⅲ:
请回答下列问题:
①0(填>、=或<);
(填>、=或<)
②在和
二个温度区间,容器内
气体浓度呈现如图1所示的变化趋势,请分别说出二个温度区间变化原因是。
③反应Ⅲ在温度为时,溶液
随时间变化的趋势曲线如图2所示。当时间到达
时,将该反应体系温度迅速升温到
, 并维持该温度。请在该图中画出
时刻后溶液的
变化总趋势曲线。


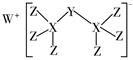
溶剂的结构简式为
 , 则
, 则中碳原子的杂化类型有,
中所含有的
键数目为,分子中第一电离能最大的元素是(填元素符号)。
的基态原子价层电子排布式为。


已知:①RCHO+CH3CHO![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②
回答下列问题:
 的合成路线(其他试剂任选)
的合成路线(其他试剂任选)