| A | B | C | D |
| | | | |
| 制纯碱 | 制NH3 | 制SO2 | 制取乙烯 |
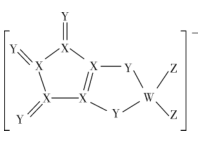

步骤Ⅰ:工业利用水钴矿(住要成分为 , 含少量
、
、
、
、
、
等)制取氯化钴晶体:

步骤Ⅱ:在活性炭的催化作用下,通过氧化制得到
流程如下:
已知:①氧化性:
②沉淀Ⅰ、沉淀Ⅱ中都只含有两种沉淀。
③以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | ||||||
开始沉淀 | 2.7 | 4.0 | 7.6 | 7.7 | 9.6 | 7.5 |
完全沉淀 | 3.7 | 5.2 | 9.6 | 9.8 | 11.1 | 9.2 |

某校化学兴趣小组根据该流程在实验室中进行实验。回答下列问题:

①装置A中橡皮管a的作用是。
②装置B中加入的目的是。
③装置C中的试剂b是。

序号 | 1 | 2 | 3 | 4 |
标准溶液体积/ | 20.05 | 18.40 | 19.95 | 20.00 |
所得产品硫酸氢钠的纯度为(以百分数表示,保留三位有效数字)。
|
反应 |
平衡常数(25℃) |
活化能(kJ/mol) |
|
a: |
1.6×1057 |
3.17 |
|
b: |
6.2×1034 |
3.17 |
|
c: |
1.1×1041 |
58.17 |
①已知: , 则
。
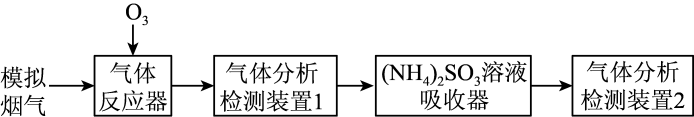
②其他条件不变,SO2和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内,SO2和NO的转化率随O3的浓度的变化如图。结合数据分析NO的转化率高于SO2的原因。


①(NH4)2SO3溶液显碱性,用化学平衡原理解释:。
②O3的浓度很低时,SO2的脱除率超过97%,原因是。
③在吸收器中,SO与NO2反应生成
和
的离子方程式是。
④在吸收器中,随着吸收过程的进行,部分被转化为N2 , 反应中
和N2的物质的量之比为1:1,该反应的离子方程式是。