










下表是元素周期表的部分信息:
| 1H 氢 |
2He 氦 |
||||||
| 3Li 锂 |
4Be 铍 |
5B 硼 |
6C 碳 |
7N 氮 |
8O 氧 |
9F 氟 |
10Ne 氖 |
| 11Na 钠 |
12Mg 镁 |
13A1 铝 |
14Si 硅 |
15P 磷 |
16S 硫 |
X | 18Ar 氩 |
| 19K 钾 |
20Ca 钙 |
||||||
认真分析信息,回答:
|
第一周期 |
1H |
2He |
||||||
|
第二周期 |
3Li |
4Be |
5B |
9F |
10Ne |
|||
|
第三周期 |
11Na |
12Mg |
13Al |
17Cl |
18Ar |
|||
|
族 周期 |
ⅣA |
VA |
ⅥA |
ⅦA |
|
2 |
6碳 12.01 |
7氦 14.01 |
8氧 16.00 |
9氟 19.00 |
|
3 |
14硅 28.09 |
15磷 30.96 |
16硫 32.06 |
17氯 35.45 |


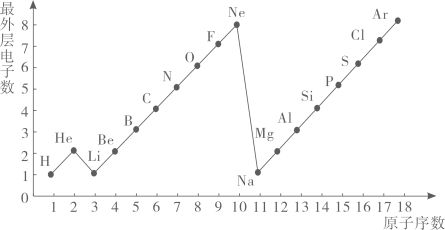
|
1 H 氢 |
| 2 He 氦 | ||||||
| 3 Li 锂 | 4 Be 铍 | …… | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 10 Ne 氖 | |
| 11 Na 钠 | 12 Mg 镁 | 13 Al 铝 | X Si 硅 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氩 | |
| 19 K 钾 | 20 Ca | …… | ||||||
认真分析信息,回答:
H:2.1 | ||||||
Li:1.0 | Be:1.5 | B:2.0 | C:2.5 | N:3.0 | O:3.5 | F:4.0 |
Na:0.9 | Mg:1.2 | A1:1.5 | Si:1.8 | P:2.1 | S:2.5 | Cl:3.0 |
K:0.8 | Ca:1. 0 | Ga:1.6 | Ge:1.8 | As:2.0 | Se:2.4 | Br:2.8 |
Rb:0.8 | Sr:1.0 | In:1.7 | Sn:1.8 | Sb:1.9 | Te:x | I:2.5 |
Cs:0.7 | Ba:0.9 | Tl:1.8 | Pb:1.9 | Bi:1.9 | Po:2.0 | At:2.2 |
Fr:0.7 | Ra:0.9 |
回答下列问题: