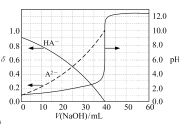
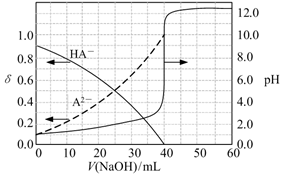
已知:A2−的分布系数为
| 实验目的 | 实验方案 | |
| A | 验证H2O2具有氧化性 | 向0.1 mol·L-1 KMnO4溶液中滴加0.1 mol·L-1H2O2溶液,可观察到溶液褪色 |
| B | 证明铜与浓硫酸反应有SO2生成 | 将浓硫酸滴加到放有铜片的试管中,并将蘸有品红溶液的湿滤纸置于试管口 |
| C | 比较Ksp(AgI)与Ksp(AgCl) 的大小关系 | 向浓度均为0.05mol·L-1的NaI、NaCl混合溶液中滴加足量AgNO3溶液,观察所产生沉淀的颜色 |
| D | 确定NaCl溶液中是否混有Na2CO3 | 取少量待测液,滴加CaCl2溶液,观察是否出现白色浑浊 |
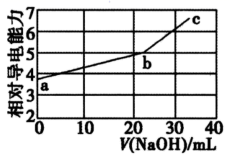
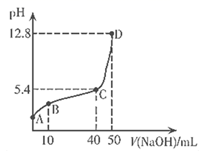
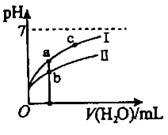
已知:Cr(OH)3为灰绿色的沉淀,当Cr3+浓度为10-5mol/L时,可认为沉淀完全,碱过量时生成[Cr(OH)4]-离子。下列说法正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向NaOH固体中加入少量稀盐酸,测得溶液温度高于室温 | 盐酸与氢氧化钠的反应为放热反应 |
| B | 向Na2SO3溶液中,加入BaCl2溶液,产生白色沉淀,过滤洗涤后,向所得沉淀中加入足量稀硝酸,沉淀不溶解 | 原Na2SO3溶液已变质 |
| C | 向pH=3的醋酸溶液中,加入醋酸铵溶液,溶液pH增大 | 醋酸铵溶液呈碱性 |
| D | 向含有少量CuCl2的MgCl2溶液中,滴加几滴氨水,产生蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| 实验序号 | 实验操作 | 实验现象 |
| 1 | 将FeCl3溶液加热片刻 | 溶液颜色变深 |
| 2 | 向FeCl3 溶液中通入少量HCl气体 | 溶液颜色变浅 |
| 3 | 向FeCl3溶液中加入少量(NH4)2SO4固体 | 溶液颜色变浅 |
| 4 | 向FeCl3溶液中加入少量NaHCO3固体 | 产生红褐色沉淀,溶液中出现大量气泡 |
下列有关说法正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeCl3溶液中通入足量的H2S | 生成两种沉淀 | Fe3+的氧化性强于S |
| B | 向浓度均为0.1 mol:L-1的CuSO4和MgSO4混合溶液中滴加少量NaOH溶液 | 先出现浅蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小 |
| C | 向FeCl3溶液中滴入几滴30%的H2O2溶液 | 有气体产生,一段时间后,FeCl3溶液颜色加深 | Fe3+能催化H2O2 分解,且该分解反应为放热反应 |
| D | 铜粉加入稀硫酸中,加热;再加入少量硝酸钾固体 | 加热时无明显现象,加入硝酸钾后溶液变蓝 | 硝酸钾起催化作用 |

下列说法错误的是( )
查阅资料:
① 为紫色固体,微溶于
溶液,具有强氧化性,在酸性或中性溶液中快速产生
,在碱性溶液中较稳定。
② 与
溶液在20℃以下反应生成
,在较高温度下则生成
。
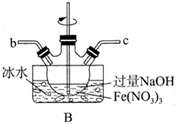
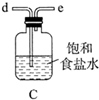
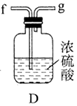
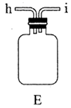
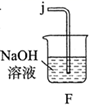
①滴定时选用的指示剂是,滴定终点的现象是。
②制得粗 的纯度是。

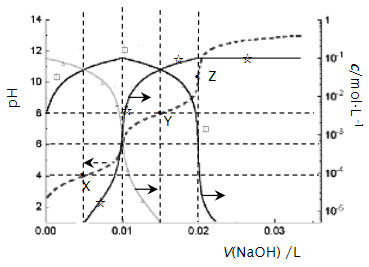
已知:金属离子浓度为 时生成氢氧化物沉淀的
| | | | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
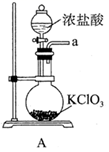
I.工业上用精炼铜的阳极泥(硒主要以CuSe形式存在,还含有少量Ag、Au)为原料与浓硫酸混合焙烧,将产生的SO2、SeO2混合气体用水吸收即可得Se固体。
已知:①H2Se(g)+1/2O2(g)⇌Se(s)+H2O(l) ΔH1=mKJ•mol−1
②2H2(g)+O2(g)=2H2O(g) ΔH2=nKJ•mol−1
③H2O(g)=H2O(l) ΔH3=pKJ•mol−1
反应H2(g)+Se(s)⇌H2Se(g)的反应热ΔH=kJ•mol−1(用含m、n、p的代数式表示)。
一种煤炭脱硫技术是把硫元素以CaSO4的形式固定下来可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率。相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s) +SO2(g)+CO2(g) △H1= +210.5kJ•mol-1
② CaSO4(s)+CO(g)
CaS(s)+CO2(g) △H2=-47.3 kJ•mol-1
反应CaO(s)+ 3CO(g) +SO2(g) CaS(s)+3CO2(g) △H3kJ•mol-1 , 平衡时增大压强,此反应将(填“向正反应方向”、“向逆反应方向”或“不”)移动。
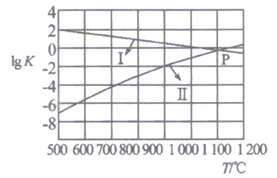
A.低温低压 B.低温高压 C.高温高压 D.高温低压
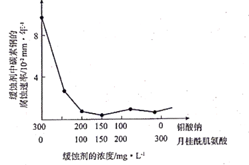
SO2与Cl2反应可制得磺酰氯(SO2Cl2),反应为SO2(g) +Cl2(g) SO2Cl2(g)。按投料比1:1把SO2与Cl2充入一恒压密闭容器中发生上述反应,SO2的转化率与温度T的关系如图所示:
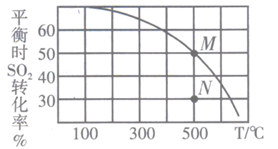
①该反应的平衡常数K(100℃)K(300℃) (填“大于”、“小于”或“等于”);在500℃下,若反应进行至N点,此时v正v逆(填“大于”、“小于”或“等于”)。
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp= (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
工业级 溶液
![]()
![]()
![]()
![]()
除杂。①向硫酸镁溶液中加入 ,加热、保持溶液温度在
,将
转化为
沉淀,反应后滤液的
(填“增大”、“不变”或“减小”);
②调节滤液的 ,使溶液呈弱碱性,向其中加入
,将
转化为
沉淀,写出该反应的离子方程式。
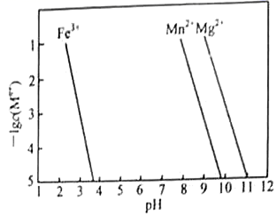
③ (
、
、
)转变为氢氧化物沉淀的
如图。除杂时未采取将
直接转化为
的原因是。
途径Ⅱ 以磷肥副产物 溶解
,充分反应后过滤、得
溶液,浓缩得
,
条件下煅烧得
。

已知:酸性环境下,KMnO4既能氧化Fe2+ , 又能氧化C2O ,自身被还原为Mn2+。
①计算样品中FeC2O4·2H2O的质量分数。 (写出计算过程)
②若滴定过程中,酸度控制不当,MnO 部分会被还原为MnO2 , 则达到滴定终点时,消耗KMnO4溶液的体积(填“偏大”、“偏小”或“不影响”)。