一种煤炭脱硫技术是把硫元素以CaSO4的形式固定下来可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率。相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s) +SO2(g)+CO2(g) △H1= +210.5kJ•mol-1
② CaSO4(s)+CO(g)
CaS(s)+CO2(g) △H2=-47.3 kJ•mol-1
反应CaO(s)+ 3CO(g) +SO2(g) CaS(s)+3CO2(g) △H3kJ•mol-1 , 平衡时增大压强,此反应将(填“向正反应方向”、“向逆反应方向”或“不”)移动。
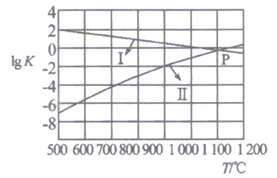
A.低温低压 B.低温高压 C.高温高压 D.高温低压
SO2与Cl2反应可制得磺酰氯(SO2Cl2),反应为SO2(g) +Cl2(g) SO2Cl2(g)。按投料比1:1把SO2与Cl2充入一恒压密闭容器中发生上述反应,SO2的转化率与温度T的关系如图所示:
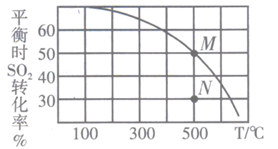
①该反应的平衡常数K(100℃)K(300℃) (填“大于”、“小于”或“等于”);在500℃下,若反应进行至N点,此时v正v逆(填“大于”、“小于”或“等于”)。
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp= (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。