| 加入溶液 | ①适量铋酸钠溶液 | ②过量双氧水 | ③适量KI-淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 溶液紫红色消失,产生气泡 | 溶液缓慢变成蓝色 |
在上述实验条件下,下列结论正确的是( )
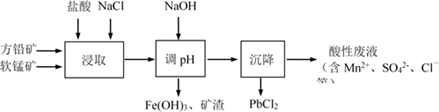
已知:i. PbCl2微溶于水
ii. PbCl2 (s) + 2Cl-(aq) PbCl42-(aq) ΔH > 0
下列说法不正确的是( )
①用饱和Na2CO3溶液做吸收剂可“捕集”CO2。写出“捕集”CO2反应的离子方式。
②聚合离子液体是目前广泛研究的CO2 吸附剂。结合下图分析聚合离子液体吸附CO2 的有利条件是。

工业上以CO2、NH3为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步:2NH3(g)+CO2(g) H2NCOONH4(s) △H = - 159.5 kJ·mol-1
第二步:H2NCOONH4(s) CO(NH2)2(s)+ H2O(g) △H = +116.5 kJ·mol-1
① 写出上述合成尿素的热化学方程式。该反应化学平衡常数K的表达式:。
② 某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入4mol NH3和1mol CO2 , 实验测得反应中各组分物质的量随时间的变化如图所示:

已知总反应的快慢由慢的一步反应决定,则合成尿素总反应的快慢由第步反应决定,总反应进行到min时到达平衡.
中国科学家首次以CH3OH、CO2和H2为原料高效合成乙酸,其反应路径如下图所示:

① 原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式。
② 根据图示,写出总反应的化学方程。
回答下列问题:

①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
A仪器的名称为。
将上述制备的CuSO4溶液按如图所示进行操作

已知浅蓝色沉淀的成分为Cu2(OH)2SO4 , 试写出生成此沉淀的离子反应方程式。
精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mLClmol/L的盐酸标准溶液完全吸收。取下接收瓶,用C2mol/L NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。

玻璃管2的作用,样品中氨的质量分数的表达式。

O2氧化MnO(OH)的化学方程式是。
① 溶液a呈酸性,原因是。
② 根据下图所示的溶解度曲线,将溶液a (填操作名称),可得NH4Cl粗品。
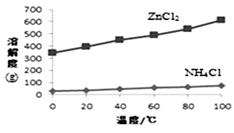
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ |
根据上表,设计方案提纯NH4Cl:
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4 , 固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4 , 固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:。
② 解释试剂加入顺序不同,MnO2作用不同的原因:
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。

根据以上信息回答下列问题:
a.与E具有相同的官能团
b.苯环上的一硝基取代产物有两种
 的合成路线。(无机试剂任选)
的合成路线。(无机试剂任选)