
O2氧化MnO(OH)的化学方程式是。
① 溶液a呈酸性,原因是。
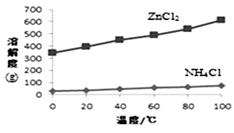
② 根据下图所示的溶解度曲线,将溶液a (填操作名称),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ |
根据上表,设计方案提纯NH4Cl:
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4 , 固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4 , 固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:。
② 解释试剂加入顺序不同,MnO2作用不同的原因:
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
微信扫码预览、分享更方便