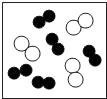
 B .
B . 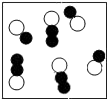 C .
C . 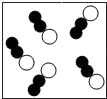 D .
D . 
 称取氯化钠
B .
称取氯化钠
B .  检查装置的气密性
C .
检查装置的气密性
C .  点燃酒精灯
D .
点燃酒精灯
D .  读取量筒的读数
读取量筒的读数


我国制作泡菜的历史悠久。制作泡菜是把新鲜蔬菜泡在低浓度的盐水里,经发酵而成。泡菜品种繁多、风味独特、口感鲜脆。
蔬菜中含有硝酸盐。硝酸盐对人体无直接危害,但转化成亚硝酸盐后,就会产生危害。亚硝酸盐[如亚硝酸钠( )]与胃酸(主要成分是盐酸)反应,产生亚硝酸(
)和氯化物(如
)。亚硝酸不稳定,产生的二氧化氮进入血液与血红蛋白结合,导致中毒。
泡菜中含亚硝酸盐吗?含量有多少?含量受什么因素影响呢?
经实验测定发现,食盐水浓度和泡制时间对泡菜中亚硝酸盐含量有一定影响。下图为室温下,食盐水浓度和泡制时间与芹菜泡制过程中亚硝酸盐含量的关系。

用不同的蔬菜进行测定,变化趋势与芹菜相似。
实验表明,发酵温度对泡菜中亚硝酸盐的生成量及生成时间也具有明显的影响。泡菜发酵过程中,泡制温度较高时,亚硝酸盐含量最大值出现的早,且数值低。这与温度较高有利于乳酸菌的繁殖有关。
实验还表明,泡制过程中添加姜汁和维生素C,都能有效地减少亚硝酸盐的生成。
现代医学证明,泡菜中的乳酸和乳酸菌对人体健康有益,具有抑制肠道中的腐败菌生长、降低胆固醇等保健作用。但是,有些泡菜盐分或糖分过高,对高血压和糖尿病等慢性病患者不利。另外,泡制过程也会造成某些营养素的流失。(有删改)
依据文章内容,回答下列问题。


请写出过氧化氢分解的反应方程式:。
(查阅资料)
①过氧化氢是人体代谢废物之一,它能够对机体造成损害,人体存在过氧化氢酶,可以催化过氧化氢分解。
②温度对化学反应的快慢有影响,人体正常体温是37℃。
(提出猜想)猜想1: 过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
(进行实验)
|
序号 |
实验步骤 |
实验现象 |
实验结论 |
|
① |
分两次进行实验,均注入5mL过氧化氢溶液 第一次在常温下进行 第二次将试管浸在37℃的温水中 |
量筒中2分钟收集到的气体体积均为5mL |
…….. |
|
② |
分两次进行实验 第一次将装有一小粒过氧化氢酶的试管浸在37℃的温水中,注入5mL过氧化氢溶液 第二次………….. |
第一次,量筒中2分钟收集到的气体体积为56mL 第二次,量筒中2分钟收集到的气体体积为5mL |
过氧化氢分解加快是因为过氧化氢酶的作用 |
实验①得出的结论是。
小林反思了实验过程,认为人体中过氧化氢酶是在体温条件下发挥作用的,实验得出的结论可能存在不足。因此又补充进行了几组实验,数据记录如下表所示。
|
加入过氧化氢酶 |
不加过氧化氢酶 |
|||||
|
反应温度/ ℃ |
25 |
37 |
42 |
25 |
37 |
42 |
|
收集到气体体积/ mL |
39 |
56 |
34 |
5 |
5 |
5 |
通过这些数据,你能得出的新结论是。