

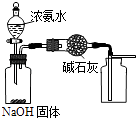
 用图装置制取干燥纯净的NH3
B .
用图装置制取干燥纯净的NH3
B . 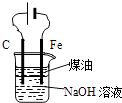 用图装置实验室制备Fe(OH)2
C .
用图装置实验室制备Fe(OH)2
C .  用图装置可以完成“喷泉”实验
D .
用图装置可以完成“喷泉”实验
D . 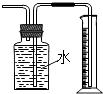 用图装置测量Cu与浓硝酸反应产生气体的体积
用图装置测量Cu与浓硝酸反应产生气体的体积
在实验室中模拟工业制取NaHCO3的实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品.
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,片刻后,C中出现固体.继续向C中通入两种气体,直到不再有固体产生.
第三步:分离C中所得的混合物,得到NaHCO3固体.
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出.


请回答: