1.
(2018·濮阳模拟)
稀土有工业“黄金”之称,我国稀土资源丰富。目前从氟碳铈矿(主要化学成分为CeFCO3)提取铈族稀土元素的冶炼处理工艺已经发展到十几种,其中一种提取铈的工艺流程如下:
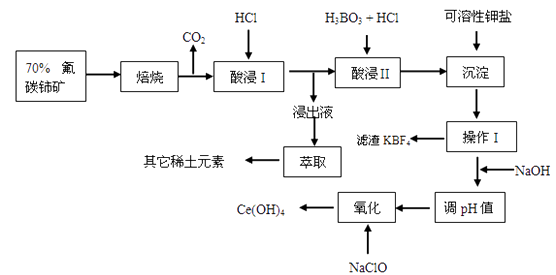
已知:①焙烧后烧渣中含+4价的铈及+3 价的其它稀土氟氧化物:
②Ce4+能与SO42-结合成CeSO4 , Ce4+能被萃取剂[(HA)2]萃取。
请回答下列问题:
-
-
-
(2)
“酸浸I”过程中CeO2转化为Ce3+ , 且产生黄绿色气体,用稀硫酸和H2O2 , 替换HCl 就不会造成环境污染。则稀硫酸.H2O2 与CeO2反应的离子方程式为:。
-
-
(3)
“沉淀”步骤中发生的反应为:Ce(BF4)3(s)+3KCl(aq)=3KBF4(s)+CeCl3 (aq)。已知Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数为 ( 用含a、b 的代数式表示)。
-
-
(4)
“浸 出 液”中含有少量Ce
4+及其他稀土元素 的离子,可以通过“萃取”与“反萃取寻探作进一步分离、富集各离子。“萃取”时Ce
4+与萃取剂[(HA)
2]存在的反应为:Ce
4++n(HA)
2 
Ce(H
2a-4A
2a)+4H
+。 用D 表示Ce
4+分别在有机层中与水层中存在形式的浓度之比(D=

) 其它条件不变,在浸出液中加入不同量的NaSO
4以改变水层中的c(SO
42-), D 随浸出液中c(SO
42-)增大而减小的原因是
。
-
-
(5)
“操作I”后,向溶液中加入NaOH 溶液,调节溶液的pH 可获得Ce(OH)3沉淀,当溶液中离子浓度小于1.0×10-6 mol/L视为沉淀完全,常温下加入NaOH 调节溶液的pH 应大 于 [已知:Ce(OH)3的Ksp=8.0×10-21 ;1g2=-0.3]
-
-
-
-
(7)
CeO
2 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧在尾气消除过程中发生着CeO
2 
CeO
2(1-x) +xO
2↑(0≤x≤0.25)的循环。写出CeO
2 消除CO 尾气的化学方程式:
。
-
