 茶饮料
B .
茶饮料
B .  苹果醋
D .
苹果醋
D .  纯牛奶
纯牛奶

松花蛋又称皮蛋、变蛋、灰包蛋等,因剥开蛋壳后胶冻状的蛋清中常有松针状的结晶或花纹而得名,是一种我国传统风味食品,口感鲜滑爽口,色香味均有独到之处。中医认为,松花蛋性凉,对牙痛、眼痛等疾病有一定疗效。由于松花蛋会有一股碱涩味,在吃松花蛋的时候可以加入少量的姜醋汁。
松花蛋是用料泥包裹鸭蛋、鸡蛋等加工而成。料泥是由生石灰、纯碱、食盐、红茶、草木灰(主要成分K2CO3)等原料与水按比例混合均匀制得。料泥制作过程中,通过一系列反应,产生的强碱(NaOH、KOH)经蛋壳渗入到蛋清和蛋黄中,与其中的蛋白质作用,致使蛋白质分解、凝固并放出少量硫化氢气体和氨气。同时渗入的碱还会与蛋白质分解出的氨基酸进一步发生中和反应,生成的盐的晶体沉积在凝胶态的蛋清中,便出现了朵朵“松花”。而硫化氢气体则与蛋清和蛋黄中的矿物质作用生成各种硫化物,使蛋清和蛋黄的颜色发生改变,蛋清呈特殊的茶褐色、蛋黄则呈墨绿色。下图表示松花蛋腌制时间与其中蛋清和蛋黄的pH的变化关系。
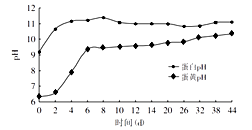
很多人在平时生活中都非常喜欢吃皮蛋瘦肉粥、凉拌松花蛋,专家提醒这种食物少吃无妨,却不能过多食用。其一,松花蛋腌制过程中蛋白质分解、变质,导致营养价值遭到了一定的破坏。其二,市售松花蛋还可能含铅(国家规定松花蛋中铅含量需小于0.5mg/kg)。微量铅很容易被儿童吸收,导致铅中毒。其三,剥开皮的松花蛋1至2小时内一定要吃完,若长时间暴露在空气中,非常容易感染沙门氏杆菌,沙门氏杆菌会快速繁殖,此时食用松花蛋很容易引起中毒现象,依据文章内容,回答下列问题。

内容 步骤 | 实验步骤 |
实验1 | B、C中分别盛有无色酚酞试液,打开K1,从分液漏斗中加入浓氨水,关闭K1 , 然后打开K2、K3。 |
实验2 | A中盛满CO2 , B中盛有氢氧化钙溶液,C中盛有稀盐酸。 ①打开K1 , 从分液漏斗慢慢放入适量的氢氧化钠溶液,关闭K1。 ②一段时间后打开K2 , 观察到有A中有沉淀产生时,迅速关闭K2。 ③再打开K3 , 观察到A中有气泡产生。 |


【查阅资料】
常温下镁粉能与水发生置换反应,且放热。
【进行实验】
同学们用下图所示装置进行模拟实验:分别取不同成分的固体粉末放入甲中,通过分液漏斗向其中均加入8 mL水,读取甲中所得固液混合物的最高温度,实验记录如下表:

(实验时的室温为22.8℃)
实验序号 | A | B | C | D | E | F |
固体成分 | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
乙中现象 | 少量肥皂泡,难以点燃 | ______ | 少量肥皂泡,难以点燃 | 较多肥皂泡,点燃有爆鸣声 | 无肥皂泡 | 大量肥皂泡,点燃有爆鸣声 |
混合物温度 | 23.1℃ | 22.8℃ | 23.1℃ | 24.2℃ | 22.8℃ | 27.2℃ |
【解释与结论】
同学们分析实验数据发现,升高的温度没有达到食品加热袋的效果,其可能的原因是。