
①氯气的发生装置可以选择上图中的(填装置编号),反应的化学方程式为。
②欲收集一瓶干燥、纯净氯气,选择上图中的装置部分装置可以重复使用,E 装置中试剂可根据需要改变),其连接顺序为:发生装置→ 按气流方向,用小写字母表示)。
将上述收集到的Cl2连接在右图Y中,在注射器X中充入NH3(中间连接管用夹子K 夹好)。按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K,推动注射器活塞,使少量NH3非常缓慢充入Y管中 | ①y 管中.没有出现明显的白烟 | ②反应的化学方程式 |
继续较快通入NH3 | Y 管中产生较多白烟 | ③产生白烟的化学方程式。 |
①设计实验证明白烟所含物质中的阳离子。
②用(2)中装置设计实验证明氯元素比硫元素非金属性强。
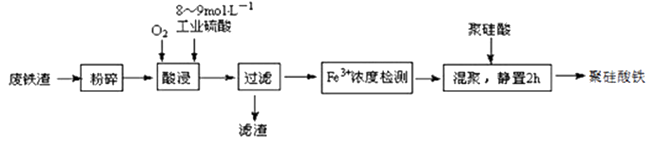
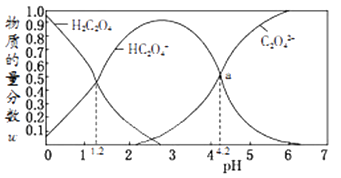
已知:在一定温度下酸浸时Fe3+在pH=2 开始沉淀,pH=3.7 沉淀完全
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式②硫酸酸浸时应控制溶液的pH,其原因是。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是。
C(s) + O2(g) = CO2(B) △H=-393.5kJ/mol
2C(g) + O2(g) = 2CO(g) △H=-221kJ/mol
则:2NO(g) + 2CO(g) = N2(g) + 2CO2(g) △H=。

①温度: T1 T2( 填“<”或“>”) 。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=(保留小数点后两位)。用CO的浓度变化表示起始到平衡的平均反应速率V(CO)=。
①肼的电子式为。
②肼能与酸反应。N2H6Cl2溶液呈弱酸性,在水中存在如下反应:
N2H62++H2O = N2H5++H3O+平衡常数K1
N2H5++H2O= N2H4+H3O+平衡常数K2
相同温度下,K1>K2 , 其主要原因有两个:
a.电荷因素,N2H5+水解程度小于N2H62+;
b.。